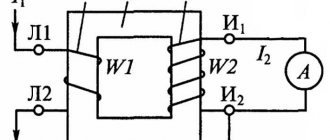
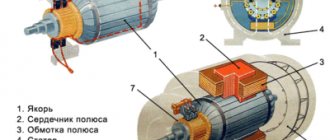
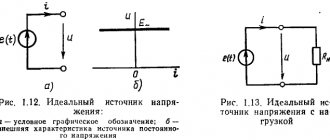
Источники тока химические (сокращенно ХИТ) — приспособления, в которых энергия окислительно-восстановительной реакции преобразуется в электрическую. Другие их названия — электрохимический элемент, гальванический элемент, электрохимическая ячейка. Принцип их действия заключается в следующем: в результате взаимодействия двух реагентов происходит химическая реакция с выделением энергии постоянного электрического тока. В прочих источниках тока процесс получения электроэнергии происходит по многоступенчатой схеме. Сначала выделяется тепловая энергия, затем она превращается в механическую и лишь после этого в электрическую. Преимущество ХИТ — одноступенчатость процесса, то есть электричество получается сразу, минуя стадии получения тепловой и механической энергий.
Химические источники тока
Категория: Бытовые товары
Химическими источниками тока называют устройства, в которых химическая энергия заложенных в них активных веществ преобразуется в электрическую энергию при протекании электрохимических реакций. Их используют для автономного питания малогабаритной радиоэлектронной аппаратуры, часов, мобильных телефонов, видеокамер и для местного освещения.
Химические источники тока подразделяются на первичные и вторичные.
Первичными химическими источниками тока являются гальванические элементы и батареи, предназначенные для разового непрерывного или прерывистого разряда.
Гальванический элемент представляет собой химический источник тока, состоящий из электродов с разным электрическим потенциалом и электролита, заключенных в один сосуд.
Гальваническая батарея — это химический источник тока, состоящий из двух или более гальванических элементов, соединенных между собой электрически.
- Ко вторичным химическими источниками тока относятся аккумуляторы, предназначенные для многократного использования за счет перезарядки электрическим током.
- По материалу электродов, химические источники тока подразделяются на марганцево-цинковые, ртутно-цинковые, литиево-ионные (Li-ion), медно-литиевые, никель-кадмиевые (Ni-Cd), никель-металло-гидридные (Ni-MH) и др.
- По форме корпуса химические источники тока бывают цилиндрические, призматические и дисковые.
- Основными параметрами химических источников тока являются: емкость, напряжение разомкнутой цепи, сохранность заряда.
- Емкость химического источника тока представляет собой величину, соответствующую количеству электричества в ампер-часах (А-ч), которое химический источник тока может отдать при разряде от начального до конечного напряжения.
В процессе хранения, химические источники тока теряют энергию из-за протекания в них самопроизвольных процессов. В этом случае говорят о саморазряде химического источника тока. Время, в течение которого химический источник тока сохраняет свои параметры в установленных пределах при соблюдении условий хранения, называется сроком сохраняемости.
На каждом элементе и батарее должны быть указаны: условное обозначение изделия; товарный знак предприятия-изготовителя; дата изготовления (месяц и год); номинальное напряжение; гарантийный срок хранения.
Маркировка и наружные неметаллические покрытия элементов должны быть устойчивы к воздействию спирто-бензиновой смеси. Химические источники рекомендуется хранить в диапазоне температур от 10°С до минус 20°С.
Вторичные источники тока или аккумуляторы
В аккумуляторах при пропускании через них электрического тока от внешнего цепи (заряд) идут химические реакции в электродах и растворах, близкие к оборотным, и работа электрического тока аккумулируется в виде свободной энергии продуктов реакции. Аккумулятор дает электрический ток при разряде, после чего снова можно его зарядить.
Рисунок 2. Общее устройство аккумулятора
Наиболее широко используют кислотный свинцовый, щелочной кадмиево — никелевый и щелочной серебряно — цинковый аккумуляторы.
3.1. Свинцовый кислотный аккумулятор
Свинцовый кислотный аккумулятор в заряженном состоянии представляет собой элемент:
(-) Pb, PbSO4 (т) | H2SO4 (32-34%) | PbO2, Pb (+)
при работе которого протекают следующие электродные реакции:
на левом катоде:
на правом электроде:
суммарная реакция процесса:
Рисунок 3. Схема действия свинцового аккумулятора
Изобарный потенциал этой реакции отражает исчезновение твердых свинца и его диоксина, возникновения твердого сульфата свинца, а также исчезновение 2 моль серной кислоты и возникновение 2 моль воды:
Так как химические потенциалы твердых фаз постоянные (при данных температуре и давлении), то
Изобарный потенциал и ЭДС аккумулятора зависят от концентрации серной кислоты (точнее — от активности компонентов раствора). В процессе разряда аккумулятора концентрация серной кислоты уменьшается, а при зарядке увеличивается.
2.3.2 кадмиево-никелевого щелочных аккумуляторов Этот аккумулятор в заряженном состоянии представляет собой электрохимический элемент:
(-) Cd | Cd (OH) 2, KOH (20%) | | KOH (20%), Ni (OH) 2, Ni (OH) 3/Ni (+)
Суммарная реакция и этом элементе:
Cd + 2Ni (OH) 3 = Cd (OH) 2 + 2Ni (OH) 2
Значение для этой реакции не должно зависеть от концентрации щелочи, так как в суммарной реакции участвуют только твердые вещества. Однако реакции на электродах сопровождаются изменением концентрации щелочи и образованием разности концентрации в двух электродов:
Эта разница должна определять концентрационную поляризацию, которая уменьшает ЭДС элемента. Однако в результате перемешивания в условиях близости электродов эта разница концентраций практически не возникает. ЭДС кадмиево — никелевого аккумулятора равна примерно 1,36 В. Используются следующие щелочные аккумуляторы, в которых кадмий и оксид кадмия заменяют железом и закисного железа.
2.3.4 серебряную — цинковых щелочных аккумуляторов Анодом является пористая цинковая пластинка, катодом оксиды серебра Ag2O и AgO, полученные электролитическим окислением металлического серебра. Электролит — концентрированный раствор КОН, насыщенный цинкаты калия Zn (OK) 2. Аккумулятор может быть представлен в виде:
(-) Zn | Zn (OK) 2 + KOH (40%) | Ag2O или AgO | Ag (+)
Суммарная реакция в этом элементе AgO + Zn = ZnO + Ag
Процесс проходит в две стадии: AgO восстанавливается сначала до Ag2O, далее до металлического серебра. ЭДС элементов с катодом AgO уровне 1,86 В, с катодом Ag2O — 1,58-1,60 В. При малой плотности тока напряжение падает на 0,3 В при переходе от первой стадии ко второй. Практически используется лишь вторая стадия. После разряда аккумулятора:
(-) Zn | ZnO, Zn (OK) 2 + KOH (40%) | Ag (+)
В таких аккумуляторах в отличие от свинцовых и щелочных электролит в реакциях заряда и разряда не участвует, поэтому его можно брать в малом количестве. Это позволило сконструировать аккумуляторы имеют очень эффективную конструкцию: электроды находятся друг к другу и разделены тонким слоем целлофана. Весь электролит находится в порах электродов. Серебряно — цинковые аккумуляторы имеют большую емкость, высокую энергию и высокую мощность на единицу массы и объема, именно этому они широко применяются там, где необходимы аккумуляторы небольшого размера.
СÑавнение иÑÑоÑников
ÐÑÑÑÑÑÑвие моÑного вÑодного ÑÑанÑÑоÑмаÑоÑа в импÑлÑÑнÑÑ Ð¸ÑÑоÑÐ½Ð¸ÐºÐ°Ñ Ð¿Ð¸ÑÐ°Ð½Ð¸Ñ Ð¿Ð¾Ð·Ð²Ð¾Ð»ÑÐµÑ ÑоздаваÑÑ ÐºÐ¾Ð½ÑÑÑÑкÑии знаÑиÑелÑно более легкие и Ñ Ð¼ÐµÐ½ÑÑими линейнÑми ÑазмеÑами. ÐÑ ÑÑÑекÑивноÑÑÑ Ð·Ð½Ð°ÑиÑелÑно вÑÑе иÑÑоÑников, вÑполненнÑÑ Ð¿Ð¾ линейнÑм ÑÑемам. ÐоÑÑÑиÑÐ¸ÐµÐ½Ñ Ð¿Ð¾Ð»ÐµÐ·Ð½Ð¾Ð³Ð¾ дейÑÑÐ²Ð¸Ñ Ð´Ð¾ÑÐ¾Ð´Ð¸Ñ Ð´Ð¾ знаÑÐµÐ½Ð¸Ñ 98%. Ð Ð½Ð¸Ñ ÑиÑокое ÑаÑпÑоÑÑÑанение полÑÑили микÑоÑÑемÑ, вÑполнÑÑÑие ÑÑнкÑии конÑÑоллеÑов.
ÐаждÑй из Ñипов ÑÑабилизиÑованнÑÑ Ð¸ÑÑоÑников поÑÑоÑнного Ñока наÑÐ¾Ð´Ð¸Ñ Ð¿Ñименение в Ñвоей ÑÑеÑе. Рона веÑÑма многообÑазна. ÐÑновой ÑвлÑÑÑÑÑ ÑаÑакÑеÑиÑÑики иÑÑоÑников поÑÑоÑнного Ñока. ÐинейнÑе иÑÑоÑники обеÑпеÑиваÑÑ Ð½Ð¸Ð·ÐºÐ¸Ð¹ ÑÑÐ¾Ð²ÐµÐ½Ñ Ð¿ÑлÑÑаÑий вÑÑодного напÑÑÐ¶ÐµÐ½Ð¸Ñ Ð¸ малое знаÑение ÑÑÐ¾Ð²Ð½Ñ ÑобÑÑвенного ÑÑма. ÐÑо доÑÑигаеÑÑÑ Ð¾ÑÑÑÑÑÑвием пеÑеклÑÑений пÑи Ð¸Ñ ÑабоÑе, коÑоÑÑе ÑоздаÑÑ Ð±Ð¾Ð»ÑÑой ÑÑÐ¾Ð²ÐµÐ½Ñ Ð¿Ð¾Ð¼ÐµÑ Ð² ÑиÑоком ÑаÑÑоÑном диапазоне. РимпÑлÑÑнÑÑ Ð¸ÑÑоÑÐ½Ð¸ÐºÐ°Ñ Ð¿ÑиÑодиÑÑÑ Ð¿ÑименÑÑÑ ÑложнÑе ÑÑемнÑе ÑеÑÐµÐ½Ð¸Ñ Ð´Ð»Ñ Ð±Ð¾ÑÑÐ±Ñ Ñ Ð½Ð¸Ð¼Ð¸, ÑÑо пÑÐ¸Ð²Ð¾Ð´Ð¸Ñ Ðº ÑдоÑÐ¾Ð¶Ð°Ð½Ð¸Ñ Ð¸Ð·Ð´ÐµÐ»Ð¸Ð¹, в коÑоÑÑÑ Ð¾Ð½Ð¸ пÑименÑÑÑÑÑ.
Классификация источников электрического тока
В таблице источников электрического тока представлены основные виды источников и механизмы их работы.
| Источник электрического тока | Механизм разделения электрических зарядов |
| Электрофорная машина | Механическая энергия вращения |
| Термоэлементы | Тепловая энергия |
| Солнечные батареи, фотоэлементы | Энергия фотонов света |
| Гальванические элементы, батарейки | Химические реакции |
| Аккумуляторы | Химические реакции |
| Электромагнитные генераторы | Механическая энергия вращения |
Постоянно предпринимаются попытки использовать механическую энергию человека для выработки электроэнергии. Например, был предложен вариант скакалки, у которой внутри цилиндрической ручки имеются полости. В них размещены аккумуляторы. Согласно расчетам 20-25 прыжков со скакалкой позволят заряжать четыре аккумуляторных батарейки.
Устройство и принцип работы ХИТ
Устройство химических источников тока включает в себя два электрода (проводники первого рода) и находящийся между ними электролит (проводник второго рода, или ионный проводник). На границе между ними возникает электронный потенциал. Электрод, на котором происходит окисление восстановителя называют анодом, а тот, на котором происходит восстановление окислителя, — катодом. Вместе с электролитом они составляют электрохимическую систему.
Побочным результатом окислительно-восстановительной реакции между электродами является возникновение электрического тока. Во время такой реакции восстановитель окисляется и отдает электроны окислителю, который их принимает и за счет этого восстанавливается. Присутствие между катодом и анодом электролита является необходимым условием реакции. Если просто смешать между собой порошки из двух разных металлов, никакого выделения электроэнергии не произойдет, вся энергия выделится в виде тепла. Электролит нужен, чтобы упорядочить процесс перехода электронов. Чаще всего в его качестве выступает солевой раствор или расплав.
Электроды выглядят как металлические пластины или решетки. При их погружении в электролит возникает разность электрических потенциалов между ними — напряжение разомкнутой цепи. Анод имеет тенденцию к отдаче электронов, а катод — к их принятию. На их поверхности начинаются химические реакции. Они прекращаются при размыкании цепи, а также когда израсходован один из реагентов. Размыкание цепи происходит при удалении одного из электродов или электролита.
Литий «с плюсом»
Функционирование литий-ионных аккумуляторов основано на способности материалов, обладающих определенной структурой (так называемой «матрицей»), к обратимому внедрению ионов лития. Такие матрицы выступают в качестве «хозяина», который предоставляет свободные пространства своей структуры «гостю» – иону лития Li+. В процессе заряда (разряда) аккумулятора эти ионы уходят из одной матрицы и внедряются в другую. Выходное электрическое напряжение таких систем чуть меньше, чем металлических литиевых, зато уровень безопасности существенно выше.
По основным техническим характеристикам ЛИА существенно превосходят «конкурентов». Так, по сравнению с никель-металло-гидридными аналогами у ЛИА вдвое больше электрохимическая емкость и почти втрое выше плотность аккумулируемой энергии и удельная мощность. ЛИА выдерживает очень высокие токи разряда, что важно для использования в мощных переносных электроинструментах. Саморазряд составляет всего 2—5 %, а количество циклов «заряда – разряда» без потери емкости у них в 4—6 раз выше, чем у предшественников. ЛИА в меньшей степени подвержены и так называемому эффекту памяти – их можно начать перезаряжать в любой момент, не дожидаясь полной разрядки.
Электрохимия как наука, изучающая взаимосвязь электрических явлений и химических реакций, началась с опытов итальянца Л. Гальвани в конце XVIII в., обнаружившего, что прикосновение металлических предметов к мышечной ткани вызывает такой же эффект (резкое сокращение), как и действие разряда от «лейденской банки» – самого первого накопителя электроэнергии. Знаменитый соотечественник Гальвани, А. Вольта, предположил, что «гальванический» эффект обусловлен наличием контакта разнородных металлов, и в 1800 г. создал прибор, производящий «неистощимый заряд». «Вольтов столб» стал первым в мире химическим источником тока (до этого единственными источниками электричества были машины, вырабатывавшие статическое электричество за счет трения). В этом источнике происходило непосредственное преобразование химической энергии в электрическую. В последующие два десятилетия было осуществлено электролитическое разложение воды на водород и кислород, а также электроосаждение металлов из растворов. Путем электролиза расплавленных солей выдающийся английский ученый Х. Дэви выделил в чистом виде щелочные металлы, в том числе и литий. С помощью химических источников тока был сделан ряд важнейших физических открытий, включая явление магнитного действия электрического тока (Ампер, 1820), закон пропорциональности тока и напряжения (Ом,1827), тепловыделение при прохождении тока (Джоуль, 1843), электромагнитную индукцию (Фарадей, 1931). А русский ученый Б. Якоби, еще в 1834 г. сконструировавший первый электродвигатель, спустя четыре года создал важнейшее практическое приложение электрохимии – гальванопластику
Но у ЛИА есть и недостатки, прежде всего – высокий риск взрывного разрушения при перезаряде или перегреве. Поэтому во все бытовые аккумуляторы встраивают электронную схему, которая ограничивает напряжение заряда. Кроме того, ЛИА полностью выводятся из строя в результате глубокой разрядки, да и вообще эти аккумуляторы пока еще довольно дороги.
Однако следует заметить, что литий-ионные технологии находятся только в начале пути, в то время как их «конкуренты» вплотную приблизились к своему теоретическому пределу. Будучи уже внедренными в промышленное производство, ЛИА до сих пор являются предметом интенсивного изучения, направленного на улучшение их электрохимических характеристик. Совершенствованию подвергаются все три компонента системы: электролит, катод и анод.
Химические источники электрического тока
Химические источники тока – это устройства, работа которых обусловлена преобразованием выделяемой при окислительно-восстановительном процессе химической энергии в энергию электрическую.
К преимуществам химических источников тока относится универсальность их применения.
Источником питания многих бытовых устройств, а также приборов, используемых в научных лабораториях или на производстве, являются именно химические источники питания.
Востребованность химических источников тока в обеспечении функционирования аппаратуры связи или портативной электронной аппаратуры заслуживает особого внимания, так как в этом случае они являются незаменимыми.
Химические источники электротока
Конструктивно химические источники тока представляют собой два металлических электрода, разделенных электролитом. Электроды изготавливаются из металла, который является проводником электронов (электронная проводимость), а электролит изготавливается из жидкого или твердого вещества, являющегося проводником ионов (ионная проводимость).
Если для питания, какого либо потребителя, требуется высокое напряжение, то электрические аккумуляторы соединяются последовательно. В случае, когда для электропитания требуется большой ток, электрические аккумуляторы соединяются параллельно и носят название аккумуляторной батареи.
Последовательное соединение (согласное включение)
Еобщ = Е1 + Е2 + Е3
Смешанное соединение (встречное)
Еобщ = Е1 – Е2 + Е3
- Параллельное соединение источников питания. ( Такое соединение применяется
- для увеличения тока в цепи. )
Еобщ = Е1 = Е2 = Е3
В зависимости от характера работы различные типы химических источников питания носят название гальванических элементов либо электрических аккумуляторов.
К отличительной особенности химических источников тока, называемых гальваническими элементами, относится возможность одноразового применения, так как их выделяющие электрическую энергию активные вещества подлежат полному распаду в процессе химической реакции. При полном разряде гальванического элемента его дальнейшее применение невозможно.
Особенностью таких химических источников тока, как электрические аккумуляторы, является их многоразовое использование за счет обратимости основных действующих процессов.
Разряженный электрический аккумулятор обладает способностью регенерировать свои дающие электрическую энергию активные вещества за счет процесса пропускания через него постоянного тока, источником которого служит другое устройство.
При заряде электрического аккумулятора постоянный тока другого источника должен протекать в направлении, противоположном разрядному току. Такое условие способствует замене реакции окисления на реакцию восстановления на положительном электроде, и наоборот, на отрицательном электроде реакция окисления заменяется на реакцию восстановления.
К химическим источникам тока предъявляется ряд общих и специальных технических требований. Все требования оговорены в соответствующей нормативной документации.
Общими являются требования: к габаритно-массовым характеристикам; к надежности; к отсутствию вредного влияния на окружающую среду; к безопасному использованию обслуживающим персоналом; к сроку службы; к минимальному саморазряду.
Специальными техническими условиями являются требования к удельным характеристикам, к механической прочности, к температурному диапазону рабочего режима, к невысокому значению внутреннего сопротивления, к работоспособности в любом положении, к удобству в эксплуатации.
Классификация гальванических элементов и их подбор
Основные понятия о релейной защите
Генераторы электрического тока получающегося во время химической реакции разделяются по:
- Размерам;
- Конструктивным особенностям;
- Способу и реагенту, за счёт которого, и получается электроэнергия.
Все элементы вырабатывающее ток во время химической реакции делятся на:
- Заряжаемые, которые в процессе эксплуатации могут неоднократно заряжаться от источника постоянного тока, они называются аккумуляторами;
- Не заряжаемые, то есть источники одноразового использования которые после завершения химической реакции просто приходят в негодность и должны быть утилизированы. Попросту это гальванический элемент или батарейка.
Для того чтобы подобрать источник электроэнергии, основанный на химической реакции, нужно понимать его характеристики, к которым относятся:
- Напряжение между анодом и катодом при разомкнутой цепи. Этот показатель чаще всего зависит от выбранной электрохимической системы, а также концентрации и вылечены всех составляющих;
- Мощность источника;
- Показатель силы тока;
- Емкость;
- Электротехнические показатели, то есть количество циклов заряда и разряда;
- Диапазон рабочих температур;
- Срок хранения между тем временем как элемент был создан и до начала его эксплуатации;
- Полный срок службы;
- Прочность, то есть защита корпуса от различных механических повреждений и влияний, а также вибраций;
- Положение работы, некоторые из них работают только в горизонтальных положениях;
- Надёжность;
- Простота в эксплуатации и обслуживании. В идеале отсутствие необходимости малейшего вмешательства в работу в течение всего срока эксплуатации.
При выборе нужной батареи или аккумулятора обязательно нужно учесть его электрические номиналы такие как напряжение и ток, а также ёмкость. Именно она является ключевой для сохранения работоспособности, подключаемого к источнику прибора.
Принцип действия
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
- в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (материал катода) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
ÐмпÑлÑÑнÑе иÑÑоÑники
СÑÐµÐ¼Ñ Ñ Ð¸ÑполÑзованием вÑоднÑÑ ÑÑанÑÑоÑмаÑоÑов напÑÑÐ¶ÐµÐ½Ð¸Ñ ÑеÑи полÑÑили название линейнÑÑ. РимпÑлÑÑнÑÑ Ð¸ÑÑоÑÐ½Ð¸ÐºÐ°Ñ Ð¿Ð¸ÑÐ°Ð½Ð¸Ñ Ð¿ÑоизводиÑÑÑ Ð´Ð²Ð¾Ð¹Ð½Ð¾Ðµ пÑеобÑазование — ÑнаÑала пеÑеменное напÑÑжение вÑпÑÑмиÑелем пÑеобÑазÑеÑÑÑ Ð² поÑÑоÑнное, заÑем вÑÑабаÑÑваеÑÑÑ Ð¿ÐµÑеменное импÑлÑÑное напÑÑжение более вÑÑокой ÑаÑÑоÑÑ, коÑоÑое в вÑÑодном каÑкаде Ñнова пÑеобÑазÑеÑÑÑ Ð² поÑÑоÑнное напÑÑжение необÑодимого знаÑениÑ.
ÐенеÑаÑоÑÑ Ð¸Ð¼Ð¿ÑлÑÑов вÑÑабаÑÑваÑÑ Ð½ÐµÐ¿ÑеÑÑвнÑÑ Ð¸Ð¼Ð¿ÑлÑÑнÑÑ Ð¿Ð¾ÑледоваÑелÑноÑÑÑ Ñ ÑаÑÑоÑой (15-60) кÐÑ. РегÑлиÑование вÑÑодного напÑÑÐ¶ÐµÐ½Ð¸Ñ Ð¾ÑÑÑеÑÑвлÑеÑÑÑ Ð¿Ð¾ÑÑедÑÑвом ÑиÑоÑно-импÑлÑÑной модÑлÑÑии (ШÐÐ), пÑи коÑоÑой ÑÑÐ¾Ð²ÐµÐ½Ñ Ñигнала на вÑÑоде блока пиÑÐ°Ð½Ð¸Ñ Ð¾Ð¿ÑеделÑеÑÑÑ ÑиÑиной импÑлÑÑов, вÑÑабаÑÑваемÑÑ Ð³ÐµÐ½ÐµÑаÑоÑом и знаÑением Ð¸Ñ ÑкважноÑÑи. РегÑлиÑованнÑе иÑÑоÑники пиÑÐ°Ð½Ð¸Ñ Ð¿Ð¾ÑÑоÑнного Ñока импÑлÑÑного Ñипа вÑе ÑаÑе иÑполÑзÑÑÑÑÑ Ð¿Ñи Ñоздании аппаÑаÑÑÑÑ ÑазлиÑного назнаÑениÑ.
История создания
Вольтов столб
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда.
История создания
Вольтов столб
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда.
Современные химические источники тока и их применение
Современный быт человека тяжело приставить без этих мобильных генераторов энергии, с которыми он сталкивается в течение всей жизни, начиная с детских игрушек и заканчивая, допустим, автомобилем.
Сферы применения различных батареек и аккумуляторов настолько разнообразны что перечислить их очень сложно. Работа любого мобильного телефона, компьютера, ноутбука, часов, пульта дистанционного управления была бы невозможна без этого переносного и очень компактного устройства для создания стабильного электрического заряда. В медицине широко используются источники химической энергии при создании любого аппарата, помогающего человеку полноценно жить. Например, для слуховых аппаратов и электрокардиостимуляторов которые могут работать только от переносных источников напряжения, чтобы не сковывать человека проводами. В производстве применяются целые системы аккумуляторных батарей для обеспечения напряжением цепей отключения и защит в случае пропадания входящего высокого напряжения на подстанциях. И также широко применяется это питание во всех транспортных средствах, военной и космической технике. Одним из видов распространённых батарей являются литиевые источники электрического тока, так как именно этот элемент обладает высоким показателем удельной энергии. Дело в том что только этот химический элемент, оказывается, обладает сильным отрицательным потенциалом среди всех известных и изученных человеком веществ. Литий-ионные батареи выделяются среди всех остальных элементов питания по величине вырабатываемой энергии и низким габаритам, что позволяет применять их в самых компактных и мелких электронных устройствах.
Способы утилизации химических источников энергии
Проблема утилизации разных по габаритах химических источников напряжения является экологической проблемой всей планеты. Современные источники содержат в себе до тридцати химических элементов которые могут нанесите ощутимый вред природным ресурсам, поэтому для их утилизации разработаны целые программы и построены специализированные цеха по переработке. Некоторые методы позволяют не только качественно перерабатывать эти вредные вещества, но и возвращать в производство, тем самым защитив окружающую среду. В целях извлечения цветных металлов из батарей и аккумуляторов в настоящий момент разработаны и применены в цивилизованных странах, следящих и заботящихся об окружающей среде, целые пирометаллургические и гидрометаллургические комплексы. Самый же распространённый способ утилизации отработанных химических источников тока является метод, работающий на соединении этих процессов. Главным его достоинством считается высокая степень извлечения с минимальным количеством отходов. Этот метод пирометаллургической, гидрометаллургической и механической переработки включает в себя восемь основных стадий:
- Измельчение;
- Магнитная сепарация;
- Обжиг;
- Дополнительное измельчение;
- Выделение крупных и мелких элементов с помощью грохочения;
- Водное очищение и выщелачивание;
- Сернокислотное выщелачивание;
- Электролиз.
Организация правильного сбора и утилизации ХИТ позволяет максимально уменьшить негативное влияние как на окружающую природу, так и на здоровье самого человека.
Принцип действия
Основу химических источников тока составляют два электрода (положительно заряженный анод, содержащий восстановитель, и отрицательно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
- в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (материал катода) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
История
Как появились первые источники тока? Химические источники получили название гальванических элементов в честь итальянского ученого восемнадцатого века — Луиджи Гальвани. Он был врачом, анатомом, физиологом и физиком. Одним из направлений его исследований было изучение реакций животных на различные внешние воздействия. Химический способ получения электроэнергии был открыт Гальвани случайно, во время одного из опытов над лягушками. Он подсоединил к оголенному нерву на лягушачьей лапке две металлические пластины. При этом произошло мускульное сокращение. Собственное объяснение этого явления Гальвани было неверным. Но результаты его опытов и наблюдений помогли его соотечественнику Алессандро Вольта в последующих исследованиях.
Вольта изложил в своих трудах теорию возникновения электрического тока в результате химической реакции между двумя металлами при контакте с мускульной тканью лягушки. Первый химический источник тока выглядел как емкость с соляным раствором, с погруженными в него пластинами из цинка и меди.
В промышленных масштабах ХИТ начали производиться еще во второй половине девятнадцатого века, благодаря французу Лекланше, который изобрел первичный марганцево-цинковый элемент с солевым электролитом, названный его именем. Через несколько лет эта электрохимическая ячейка была усовершенствована другим ученым и являлась единственным первичным химическим источником тока до 1940 года.
Где применяются
Кажется, что вырабатываемый ток в результате химической энергии имеет минимальные показатели и может применяться только для изготовления обычных батареек в плеер или часы. Но это не так. Электроэнергия, полученная таким образом, используется в таких сферах:
- транспортной;
- космической;
- медицинской;
- в простом быту.
Принцип использования
Благодаря своей конструкции и принципу работы подобные устройства являются универсальными и могут применяться во многих сферах и отраслях.
Обратите внимание! Самой популярной в настоящее время является химическая батарея, которая используется в быту и производствах, подпитывая разнообразные приборы и устройства. Также в повседневной жизни используются аккумуляторы для электроники и автомобилей.
Электроэнергия — это жизненно необходимый ресурс для современного человечества. Получить электричество можно благодаря определенным источникам тока, но самыми популярными и удобными являются именно химические. Дополнительно они считаются весьма безопасными в экологическом плане для использования, если правильно их утилизировать.
Немного истории создания ХИТ
Ещё в восемнадцатом веке итальянский учёный Луиджи Гальвани придумал простейший элемент который химическим способом выделял электрический ток. Однако он был не только учёным, но и физиком, врачом, физиологом. Он интересовался и проводил опыты которые были направлены на изучение реакции животных на внешние раздражители. Как и всё гениальное первый химический источник энергии был получен Луиджи абсолютно случайно, во время многочисленных экспериментов над лягушками. После присоединения двух пластин из металла к лягушачьей мышце на лапке, было замечено мускульное сокращение. Гальвани посчитал это нервной реакцией на внешний раздражитель и изложил это в результатах своих исследований, попавших в руки другого великого учёного Алессандро Вольта. Он и выложил свою теорию о возникновении напряжения в результате химической реакции, возникшей между двумя металлическими пластинами в среде мускульной ткани лягушки.
Первый химический источник электрического тока представлял собой емкость с соляным составом, в который было погружено две пластины из разных материалов. Одна из меди, другая из цинка. Именно это устройство в будущем, а конкретнее во второй половине девятнадцатого века, было применено при изобретении и создании марганцево-цинкового элемента внутри которого был тот же солевой электролит.
Снова об онлайновых генераторах приложеиий
В предыдущей статье данного цикла мы обсуждали создание приложений для платформы Android с помощью Java и Android Development Tools (ADT). Сегодня мы продолжим данную тему, познакомившись с новым продуктом компании Embarcadero — RAD Studio XE 5. По сути, этот продукт представляет собой современную инкарнацию Delphi, инструмента разработки Windows-приложений, невероятно популярного в нашей стране в течение многих лет, начиная с первой 16-разрядной версии, появившейся во второй половине 1990-х годов. Но, в отличие от Delphi конца 1990-х и начала 2000-х, RAD Studio XE 5 представляет собой инструмент, позволяющий создавать приложения не только для Windows, но и для Mac OS, Android, iOS, причем, что немаловажно, на основе одного и того же исходного кода и ресурсов — создав проект приложения, можно просто скомпилировать исполняемый код для любой из названных платформ. Разработка мобильных приложений возможна с помощью редакций Architect, Ultimate, Enterprise, а также редакции Professional при условии приобретения вместе с ней модуля расширения Mobile Add-On Pack. Сама среда разработки доступна только для платформы Windows. При желании в RAD Studio XE 5 можно вести разработку и на C++Builder, а также создавать приложения HTML-5.
Настоящую публикацию нельзя рассматривать как традиционный обзор продукта — подобно всем статьям данного цикла, она дает представление об инструменте посредством описания процесса создания мобильного приложения с минимальными усилиями.
Знакомство с RAD Studio XE 5 можно осуществить, загрузив 30-дневную ознакомительную версию продукта на сайте компании Embarcadero (она доступна для различных версий Windows). Процесс установки продукта осуществляется непосредственно с сайта производителя, поэтому стоит заниматься этим, обеспечив себе надежное и не слишком медленное интернет-соединение.
После установки собственно RAD Studio XE 5 стоит озаботиться установкой средств поддержки тех платформ, для которых предполагается создавать приложение. Так, для разработки приложений для платформы Android нужен уже знакомый нам по предыдущей статье Android SDK с поддержкой выбранных версий платформы — его можно установить, запустив приложение Android Tools из комплекта поставки RAD Studio XE 5 (рис. 1).
Рис. 1. Выбор приложения для модификации
Если тестирование приложения предполагается на реальном устройстве, на компьютер со средой разработки следует установить его драйвер (обычно его можно найти или на сайте производителя устройства, или на сайте компании Google). На самом устройстве следует разрешить в настройках удаленную отладку приложений.
Для разработки приложений iOS потребуется компьютер c Mac OS X для запуска эмулятора. При отсутствии последнего можно воспользоваться облачным сервисом компании Embarcadero MacinCloud, у которого также предусмотрен ознакомительный период длительностью в 24 часа. Для тестирования приложений iOS на мобильных устройствах и последующей загрузки их в AppStore следует также вступить в программу Apple iOS Developer Program либо в аналогичную программу для вузов или корпоративных клиентов.
Сама среда разработки выглядит вполне традиционно (рис. 2) — менеджер проектов (Project Manager, справа вверху), палитра компонентов c группами интерфейсных элементов и так называемых невизуальных компонентов (Tool Palette, справа внизу), дерево со структурой компонентов формы (Structure, слева вверху), инспектор объектов (Object Inspector, слева внизу), редактор форм и кода (в центре).
Рис. 2. Замена логотипа приложения
Создание нашего самого первого приложения (как всегда, посвященного знакомству с журналом КомпьютерПресс) мы начнем с применения готового шаблона. Для этого в главном меню среды разработки выберем пункт File->New->FireMonkey Mobile Application и среди предложенных шаблонов приложений выберем элемент Tabbed with Navigation (рис. 3).
Рис. 3. Редактирование кнопок
В результате будет сгенерирован проект приложения, подобного тому, создание которого было описано в предыдущей статье данного цикла, и представляющего собой блокнот с четырьмя вкладками, на каждой из которых можно в дальнейшем располагать интерфейсные элементы (рис. 4).
Рис. 4. Настройка функциональности кнопок
Выбирая в правом верхнем углу редактора форм потенциальную платформу для выполнения приложения, можно увидеть, как оно будет выглядеть при исполнении на той или иной платформе.
Далее, выбирая с помощью мыши интерфейсные элементы (в нашем случае ярлычки и заголовки вкладок), мы можем менять надписи на них, воспользовавшись в инспекторе объектов свойством Text.
Для приложений iOS с помощью свойства StyleLookup можно также выбрать иконки, размещаемые на ярлычках блокнота (рис. 5).
Рис.5. Виджеты, доступные для выбора
Следующим шагом создания нашего приложения будет добавление интерфейсных элементов на вкладки блокнота. Для этого щелкнем по ярлычку «О журнале», на палитре компонентов в группе Standard выберем компонент TMemo (пользователям Delphi он хорошо знаком, а для новичков сообщу, что это просто многострочный редактор текста) и поместим его на форму. Найдем в инспекторе объектов свойство Strings, щелкнем по кнопке с многоточием и в открывшийся редактор свойств скопируем позаимствованные с нашего вебсайта www.compress.ru краткие сведения о нашем журнале. Из списка возможных значений свойства Align нашего компонента Memo1 выберем значение alClient — в этом случае наш текстовый редактор займет всю область экрана между заголовком и ярлычками. И наконец, свойство Enabled этого компонента установим равным False, чтобы пользователь нашего приложения не мог редактировать текст (рис. 6).
Рис. 6. Публикация приложения для тестирования
Повторим все те же действия с вкладкой «Рубрики», поместив в созданный компонент Memo2 позаимствованный с того же вебсайта текст о рубриках журнала.
Далее придадим нашему приложению некоторое разнообразие — на следующие две вкладки поместим не текстовый редактор, а браузер — компонент TWebBrowser (его можно найти в группе Internet палитры компонентов). Изменим свойство Align этих компонентов на значение alClient. Далее заполним их свойства URL. Для компонента на вкладке «Наш сайт» в качестве значения этого свойства введем https://www.compress.ru, а для компонента TWebBrowser на вкладке «Координаты» — ссылку на сервер «Яндекс.Карты», в которой будет указан результат поиска здания редакции на карте Москвы. Затем сохраним проект.
Пока наше приложение обладает определенными недостатками: к примеру, у него отсутствует возможность вернуться на предыдущую страницу в браузерах на третьей и четвертой вкладках. Исправим этот недостаток. Для этого в верхней части одной из вкладок браузера разместим две кнопки TSpeedButton, привязав одну из них к левому верхнему, а другую — к правому верхнему углу с помощью выбора опций akTop, akLeft, akRight свойства Anchors каждой из кнопок и добавив на них изображения стрелок с помощью уже знакомого нам свойства StyleLookup (рис. 7).
Рис. 7. Готовое приложение — снимки экрана iPhone 5
Щелкнем дважды по каждой из кнопок, после чего будут сгенерированы пустые обработчики событий, связанных с нажатием на них. Допишем в них по одной строке кода (выделены жирным шрифтом):
procedure TTabbedwithNavigationForm.SpeedButton1Click(Sender: TObject);
begin
WebBrowser1.GoForward;
end;
procedure TTabbedwithNavigationForm.SpeedButton2Click(Sender: TObject);
begin
WebBrowser1.GoBack;
end;
Эти две строки кода означают, что при нажатии на одну из кнопок происходит перемещение на предыдущую страницу, открывавшуюся в браузере, а при нажатии на вторую — перемещение на последующую.
И наконец, выделим обе кнопки, скопируем их в буфер обмена, перейдем на вкладку со вторым браузером и изымем их из буфера обмена. Если сделать это аккуратно, кнопки скопируются вместе со свойствами и обработчиками событий. Сохраним проект.
Собственно, на этом создание приложения будет завершено. Теперь его можно компилировать и тестировать. Начнем с компиляции приложения для платформы iOS. Для начала нужно подключиться к компьютеру с Mac OS Х, находящемуся в одной сети с Windows-компьютером, на котором ведется разработка, или к сервису MacinCloud. В первом случае нужно также установить на компьютер с Mac OS Х консольное приложение Platform Assistant и запустить его, а затем ввести пароль для доступа к нему среды разработки RAD Studio XE 5. Затем следует описать соединение с этим компьютером, выбрав в главном меню среды разработки опцию Tools->Options. Раздел Connection Profile Manager диалоговой панели Options содержит список профилей соединения, в который можно добавить новый профиль, указав имя компьютера и пароль для доступа к запущенному экземпляру приложения Platform Assistant (рис. 8).
Рис. 8. Электронная книга, созданная с помощью соответствующего шаблона
Протестировать соединение следует с помощью кнопки Test Connection. В случае возникновения проблем стоит проверить, доступен ли компьютер с запущенным приложением Platform Assistant в сети и открыт ли порт, по которому осуществляется соединение между компьютерами.
После успешного соединения с приложением Platform Assistant в менеджере проектов выберем соответствующую платформу и настроенный профиль соединения с компьютером с Mac OS (рис. 9).
Рис. 9. Создание приложения для iPad
Выбираем опцию главного меню Run->Run или нажимаем клавишу F9. Ждем некоторое время — и на экране компьютера с Mac OS X появится эмулятор iPhone с нашим приложением.
Теперь попробуем скомпилировать это же приложение для запуска на платформе Android. Подключим устройство, используемое для тестирования, выберем устройство и платформу в разделе Target Platforms менеджера проектов и снова запустим приложение на выполнение с помощью клавиши F9.
Через относительно небольшой промежуток времени наше приложение запустится на подключенном устройстве.
Итак, мы создали кроссплатформенное приложение, которое может выполняться под управлением как iOS, так и Android. При этом нам не потребовалось использовать ни специальных сред выполнения, ни кодогенерации с последующей компиляцией в средах разработки наподобие Xсode или Eclipse + ADT — RAD Studio XE 5 создает так называемые native-приложения. Это означает, что производительность таких приложений должна быть сравнима с производительностью приложений, созданных, к примеру, с помощью Xсode или ADT.
Чудес, конечно, не бывает — размеры исполняемых файлов, созданных с помощью RAD Studio XE 5, будут, пожалуй, побольше, чем в случае применения Xсode или ADT. Но место на мобильных устройствах, согласитесь, сегодня не самый дорогостоящий ресурс — гораздо дороже обойдутся вложения в знания и умения разработчиков мобильных приложений. И вот тут RAD Studio XE 5 пока вне конкуренции — поддержка сразу двух самых популярных мобильных платформ означает, что не нужно иметь отдельные команды разработчиков для iOS и Android. Немаловажно и то, что компаниям, решившим внедрить RAD Studio XE 5, на российском рынке труда доступно огромное количество знатоков Delphi и C++Builder самого разного возраста и с самым разнообразным опытом — ведь этому инструменту, какникак, почти 20 лет.
В заключение хочу обратить внимание на то, что на сайте компании Embarcadero имеется огромное количество учебных материалов, посвященных разработке мобильных приложений с помощью RAD Studio XE 5, и эта коллекция материалов постоянно пополняется. Поэтому освоить данный инструмент будет не слишком сложно даже новичкам.
ППредыдущие две статьи данного цикла были посвящены краткому знакомству с профессиональными инструментами разработки приложений с помощью Android Development Toolkit и нового продукта компании Embarcadero — RAD Studio XE 5. Тему профессиональных инструментов для создания мобильных приложений мы на этом завершаем, а сегодня вернемся к онлайновым сервисам генерации приложений, применение которых, как мы уже знаем, в ряде случаев может оказаться более эффективным, нежели самостоятельная разработка с помощью профессиональных инструментов.
Сервис, которому посвящена сегодняшняя статья, носит название iBuildApp и представляет собой онлайновый конструктор приложений для смартфонов, не требующий от пользователя никаких навыков программирования. Он принадлежит одноименной американской компании с российским представительством во Владимире.
Создавать приложения с помощью сервиса iBuildApp можно бесплатно, публиковать их в онлайновых магазинах приложений можно (но не обязательно) своими силами. При этом владельцы сервиса оказывают пользователям ряд платных услуг, таких как публикация приложений в онлайновых магазинах для тех, кто не готов заниматься публикацией самостоятельно, содействие в монетизации приложений (то есть в получении прибыли за счет размещения в них рекламы), рассылка push- и GPS-уведомлений пользователям приложений, круглосуточная поддержка по электронной почте. Оплата услуг возможна помесячно в соответствии с различными тарифными планами, отличающимися количеством загрузок приложения и доступностью перечисленных выше услуг. При этом все тарифные планы, в том числе и бесплатный, включают доступ к готовым шаблонам приложений (среди них имеются бесплатные и платные) и встраиваемым компонентам (виджетам), техподдержку, возможность видеть статистику работы и загрузки приложения.
О шаблонах приложений и готовых виджетах слеудет упомянуть особо — их у этого сервиса очень много. Доступны шаблоны для разных типов компаний, видов деятельности, категорий приложений, при этом у готового шаблона можно менять варианты оформления и добавлять к нему виджеты. При желании можно создать свои шаблоны и виджеты и разместить их в каталоге инструментов iBuildApp либо заказать разработку виджета или даже целого приложения у владельцев данного сервиса.
Давайте посмотрим, что можно создать с помощью бесплатного тарифного плана. Начнем с традиционного для нашего цикла приложения КомпьютерПресс со сведениями о нашем журнале. Для этого нужно выбрать либо шаблон, либо почти готовое приложение, которое можно модифицировать.
Из готовых приложений выберем «Малый бизнес» — редакции журналов по большей части относятся именно к этой категории компаний (рис.1).
После выбора мы окажемся в редакторе приложений, в котором, раскрывая последовательно или в произвольном порядке элементы перечня возможных действий, можно настроить его внешний вид или функциональность, к примеру заменить фон или логотип (рис. 2).
Хотелось бы обратить внимание на поддержку русского интерфейса приложений и наличие русского интерфейса у онлайнового редактора приложений — сейчас далеко не все подобные сервисы обладают даже первой из этих особенностей.
Далее можно внести изменения в количество и внешний вид кнопок, при этом имеется возможность выбирать для них свои графические изображения (рис. 3).
Функциональность кнопок, доступную по умолчанию, также можно заменить на нужную. В частности, имеется возможность выбора необходимых виджетов из довольно обширного списка, настройки их параметров, например ввода текста и рисунков в случае виджета, отображающего статический HTML-документ (рис. 4).
Среди доступных сегодня виджетов имеются виджеты отображения RSS-каналов, HTML-документов, интерфейсы с Twitter и Facebook, списки видеороликов с YouTube и Vimeo, интерфейсы с телефоном, почтовым клиентом, картографическими сервисами Google Map, средством управления контактами, калькулятором, камерой, фотогалерея, электронная книга, сканер QR-кодов, произвольные формы ввода с выбираемыми пользователем интерфейсными элементами и многие другие (рис. 5).
У пользователей также есть возможность создания собственных виджетов и шаблонов для применения их в своих приложениях.
Закончив формировать функциональность, можно сделать приложение доступным для загрузки в соответствии с тарифным планом. Бесплатный тарифный план предполагает два способа публикации приложения: создание пакета для загрузки на устройство под управлением операционной системы Android (что означает отсутствие необходимости публиковать приложение в магазине Google Play) и создание приложения HTML5 (и это означает, что мы сможем протестировать его на устройстве под управлением iOS, не занимаясь публикацией приложения в AppStore и не приобретая лицензию разработчика iOS, — рис. 6).
На рис. 7 представлены снимки экрана iPhone 5, на котором запущено готовое приложение, загруженное по представленной выше ссылке.
Поскольку мы используем бесплатный тарифный план, приложение содержит рекламную заставку сервиса iBuildApp, демонстрируемую во время загрузки приложения, рекламную строку на титульной странице и рекламные баннеры, появляющиеся в верхней части остальных страниц при их открытии (их, тем не менее, можно закрыть).
«Малый бизнес» — это не единственный вид приложений, доступный пользователям сервиса iBuildApp. Спектр потенциальных потребителей готовых приложений и шаблонов этого сервиса весьма разнообразен — от кафе и ресторанов до религиозных организаций. К примеру, весьма неплохо выглядит электронная книга, созданная из соответствующего шаблона (рис. 8).
Помимо приложений для смартфонов сервис iBuildApp позволяет также создавать приложения для iPad. Выбор шаблонов для данного вида приложений пока невелик, и протестировать готовое приложение можно только в браузере (рис. 9).
Помимо создания приложений пользователь сервиса может создавать свои шаблоны приложений (для этого имеется онлайновый редактор шаблонов с поддержкой операций drag-and-drop) и продавать их, а также создавать свои виджеты с помощью XCode или Android SDK. Но при нежелании заниматься вопросами дизайна форм, приобретения лицензии разработчика и применения средств разработки можно обойтись готовыми шаблонами и виджетами.
На этом мы завершаем наше знакомство с сервисом iBuildApp для быстрой генерации мобильных приложений. От аналогичных сервисов он отличается большим количеством доступных для использования шаблонов и готовых приложений, полной поддержкой русского языка, причем не только в создаваемых приложениях, но и в онлайновом редакторе приложений, весьма гибкой ценовой политкой и широким спектром возможностей, доступных бесплатно или за символическую плату. Потенциальными потребителями подобного сервиса могут быть компании и организации самого различного профиля: кафе, рестораны, медицинские учреждения, фитнес-клубы, торговые предприятия, электронные магазины, учебные заведения, издательские дома, онлайновые магазины, клубы. Если у подобного потребителя имеется потребность в русскоязычном мобильном приложении с более или менее стандартной функциональностью, ему стоит обратить внимание на этот сервис — его применение с высокой вероятностью окажется граздо более эффективным, нежели осуществление или заказ индивидуальной разработки.
КомпьютерПресс 12’2013
Принцип действия
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
- в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (материал катода) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
Общая характеристика
Любой электрохимический элемент в принципе является источником электрического тока. Однако для практического использования в качестве источника тока пригодна лишь незначительная часть этих элементов. Это связано с тем, что элемент должен иметь достаточно большую электрическую емкость, высокую скорость и оборачиваемость электрохимических процессов, стабильность при эксплуатации, технологичность и экономичность производства. Все химические источники тока (ХИТ) делятся на три группы: источники тока одноразового действия (гальванические элементы), источники тока многоразового действия (аккумуляторы), топливные элементы. В первичных ХДС электродные материалы загружаются в элемент при изготовлении, и элемент эксплуатируется, пока его напряжение не упадет до некоторого критического значения. Электродные материалы ХДС, отработавших, идут в отходы или частично перерабатываются для регенерации компонентов. В аккумуляторах электроактивные вещества в ходе предварительного электролиза (заряд аккумулятора). В процессе эксплуатации они расходуются (разряд аккумулятора), а напряжение аккумулятора снижается до некоторой предельно допустимой величины, после чего снова проводят заряд. Процессы заряда и разряда образуют цикл работы аккумулятора. Максимальное число циклов (обычно несколько сотен) зависит от типа аккумулятора и условий его эксплуатации. Работа ХДС характеризуется рядом параметров, от которых зависит возможность использования ХДС для тех или иных потребностей. Электродвижущая сила (ЭДС) химического источника тока, как и любого электрохимического круга, определяется разностью потенциалов электродов (анода и катода) при разомкнутом внешнем круге. Полным внутренним сопротивлением r ХДС называется сопротивление, оказываемое им при прохождении внутри него постоянного тока
где ЭП — ЭДС поляризации: I — сила тока.
Первая из этих составляющих r0 называется омическим сопротивлением и представляет собой сумму сопротивлений электродов и электролита. Вторая составляющая Rп — обусловлена ??изменением потенциалов электродов при прохождении тока и называется сопротивлением поляризации, или фиктивным сопротивлением, его величина зависит от величины тока. В процессе разряда ХДС полный внутреннее сопротивление увеличивается из-за изменения состава электролита и электродов. Наличием внутреннего сопротивления обусловлено то, что разрядное напряжение Up (т. е. напряжение при замкнутом внешнем круге) всегда меньше ЭДС источника тока:
(Нижний индекс «р» означает разряд).
При постоянной величине тока и постоянной температуре электролита разрядное напряжение уменьшается во времени. Зарядное напряжение Uз оборотных систем выражается уравнением:
При постоянной величине зарядного тока зарядное напряжение увеличивается во времени вследствие увеличения ЭП. В конце заряда, когда происходит в основном процесс электролиза воды, значение Uз стабилизируется. Разрядной емкостью (емкостью по току) Qр называется и количество электричества, которая может быть получена от ХДС при данных условиях работы, т. е. при заданных температуре, величине разрядного тока и конечном значении разрядного напряжения.
РегÑлиÑование иÑÑоÑника
ÐÐ»Ñ Ð¾Ð±ÐµÑпеÑÐµÐ½Ð¸Ñ Ð¿Ð¾ÑÑоÑнного знаÑÐµÐ½Ð¸Ñ ÑÑÐ¾Ð²Ð½Ñ Ð²ÑÑодного напÑÑжениÑ, не завиÑÑÑего Ð¾Ñ Ð¿Ð¾ÑÑеблÑемого нагÑÑзкой Ñока и колебаний вÑодного пеÑеменного напÑÑжениÑ, вÑе ÑовÑеменнÑе иÑÑоÑники пиÑÐ°Ð½Ð¸Ñ Ð¿Ð¾ÑÑоÑнного Ñока имеÑÑ ÑÑÑÐ¿ÐµÐ½Ñ ÑÑабилизаÑии и ÑегÑлиÑованиÑ.
Рней вÑÑодное напÑÑжение ÑÑавниваеÑÑÑ Ñ ÑÑалоннÑм (опоÑнÑм) знаÑением.
ÐÑи поÑвлении ÑазлиÑÐ¸Ñ Ð¼ÐµÐ¶Ð´Ñ Ð½Ð¸Ð¼Ð¸ вÑÑабаÑÑваеÑÑÑ ÑпÑавлÑÑÑий Ñигнал, коÑоÑÑй по Ñепи ÑпÑÐ°Ð²Ð»ÐµÐ½Ð¸Ñ Ð¸Ð·Ð¼ÐµÐ½ÑÐµÑ Ð²ÐµÐ»Ð¸ÑÐ¸Ð½Ñ Ð²ÑÑодного напÑÑжениÑ. ÐелиÑÐ¸Ð½Ñ Ð·Ð½Ð°ÑÐµÐ½Ð¸Ñ Ð¾Ð¿Ð¾Ñного напÑÑÐ¶ÐµÐ½Ð¸Ñ Ð¼Ð¾Ð¶Ð½Ð¾ изменÑÑÑ Ð² ÑиÑÐ¾ÐºÐ¸Ñ Ð¿ÑеделаÑ, Ð¸Ð¼ÐµÑ Ð½Ð° вÑÑоде ÑегÑлиÑованного иÑÑоÑника пиÑÐ°Ð½Ð¸Ñ Ð¿Ð¾ÑÑоÑнного Ñока необÑодимое Ð´Ð»Ñ ÑабоÑÑ Ð½Ð°Ð¿ÑÑжение.
Принцип действия
Основу химических источников тока составляют два электрода (положительно заряженный анод, содержащий восстановитель, и отрицательно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
- в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (материал катода) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
Топливные элементы
В наше время большая часть электроэнергии вырабатывается на тепловых электростанциях при сжигании природных энергоносителей (угля, нефти, природного газа). При этом процесс преобразования химической энергии топлива в электрическую проходит через три стадии: превращение химической энергии в тепловую при сгорании топлива, далее — тепловой энергии в механическую работу в паровой машине, наконец, превращения механической работы в электроэнергию в генераторе. На всех этих стадиях теряется энергия и коэффициент полезного действия (КПД) современных тепловых электростанций составляет около 40%, а для большинства электростанций — 25%. Термодинамический анализ, проведенный еще в конце XIX в. ., Показал, что в гальванических элементах нет такого ограничения КПД, как в тепловых машинах. В 1893 г. Нернст вычислил, что если бы удалось превращать химическую энергию угля в электрическую электрохимическим путем, то максимальный теоретический КПД такого процесса составил бы 99,75%. Однако из-за многочисленных технических трудностей первые работоспособные топливные элементы удалось создать лишь вх годах ХХ ст. . Топливными элементами называют гальванические элементы, в которых электрохимически активными веществами служат обычные горючие вещества и кислород, а процессом генерирования тока является окисление горючих веществ. При работе элемента проводится непрерывная подача реагентов и видвидення продуктов реакции, так что состав системы практически не меняется. При работе любого химического источника тока проходит суммарная химическая реакция взаимодействия окислителя с восстановителем. Максимальная электрическая работа, полученная при работе источника тока, равна уменьшению изобарного потенциала для этой реакции:
Преобразование энергии в электрическую путем топливных элементов довольно сложный процесс. Максимальная электрическая работа, полученная при сложном преобразовании, определяется тепловым эффектом реакции
Наиболее реакционно способным видом топлива является водород. Водородно — кислородные элементы обычно изготавливают с применением мелко мелких угольных или никелевых электродов погружены в щелочной раствор электролита. Схематично такой элемент можно представить в следующем виде:
(-) (Ni) H2 | KOH (30-40%) | O2 (Ni) (+)
Рисунок 4. Водородно-кислородный топливный элемент
При работе элемента на отрицательном электроде протекает электродная реакция:
На положительном
Суммарная реакция
Теоретическое значение ЭДС водородно — кислородного элемента при 250С равна 1,229 В и не зависит от состава раствора — электролита. При разряде водородно — кислородных элементов напряжение держится в пределах 07, — 0,9 В, в зависимости от плотности разрядного тока на электродах (в луговых конструкциях элементов плотность тока достигает 200-300 мА/см2). Другие виды газообразного топлива (оксид углерода, углеводороды) практически могут быть использованы в топливных элементах только при повышенных температурах (выше С). В таких высокотемпературных элементах в качестве электролита используют или расплавы углеродных солей щелочных металлов, или твердые электролиты с анионными (кислородной) проводнистю. Попытки непосредственно использовать твердый уголь в топливных элементах пока безуспешны. Уголь может быть использовано только после предварительной газификации его. Если газификацию проводить с помощью СО2, наблюдается следующая последовательность реакций:
Газификация В топливном элементе Суммарная реакция
Водород — кислородный элемент можно создать, например, с помощью двух платиновых электродов, погруженных в водный раствор гидроксида калия. Один электрод омывается водородом, другой — кислородом; Pt (H2) | KOH, насыщенный H2 | KOH, насыщенный О2 | (O2) Pt. В этом элементе окисления водорода и восстановления кислорода пространственно разделены, и ток генерируется в процессе реакций:
Т. е. суммарный процесс сводится к окислению водорода кислородом с образованием воды. Существенным недостатком, такого топливного элемента очень малая плотность тока. Для увеличения плотности тока используют повышенное давление и температуру, специальные конструкции электродов, перемешивания раствора и т. п.. Разработка топливных элементов продолжается. Принципиально доказана возможность использования некоторых видов топлива в топливных элементах и ??превращение их химической энергии в электрическую с практическим КПД до%.
Некоторые виды химических источников тока
Гальванические элементы
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
| Тип | Катод | Электролит | Анод | Напряжение,В |
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
- Свинцово-плавиковый элемент
- Медно-окисный гальванический элемент
- Висмутисто-магниевый элемент
- Ртутно-висмутисто-индиевый элемент
- Литий-хромсеребряный элемент
- Литий-висмутатный элемент
- Литий-окисномедный элемент
- Литий-йодсвинцовый элемент
- Литий-йодный элемент
- Литий-тионилхлоридный элемент
- Литий-оксидванадиевый элемент
- Литий-фторомедный элемент
- Литий-двуокисносерный элемент
- Диоксисульфатно-ртутный элемент
- Серно-магниевый элемент
- Хлористосвинцово-магниевый элемент
- Хлорсеребряно-магниевый элемент
- Хлористомедно-магниевый элемент
- Иодатно-цинковый элемент
- Магний-перхлоратный элемент
- Магний-м-ДНБ элемент
- Цинк-хлоросеребряный элемент
- Хлор-серебряный элемент
- Бром-серебряный элемент
- Йод-серебряный элемент
- Магний-ванадиевый элемент
- Кальций-хроматный элемент
Электрические аккумуляторы
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
Смотри также Категория: Аккумуляторы.
- Железо-воздушный аккумулятор
- Железо-никелевый аккумулятор
- Лантан-фторидный аккумулятор
- Литий-железо-сульфидный аккумулятор
- Литий-ионный аккумулятор
- Литий-полимерный аккумулятор
- Литий-фторный аккумулятор
- Литий-хлорный аккумулятор
- Литий-серный аккумулятор
- Марганцево-оловянный элемент
- Натрий-никель-хлоридный аккумулятор
- Натрий-серный аккумулятор
- Никель-кадмиевый аккумулятор
- Никель-металл-гидридный аккумулятор
- Никель-цинковый аккумулятор
- Свинцово-водородный аккумулятор
- Свинцово-кислотный аккумулятор
- Свинцово-оловянный аккумулятор
- Серебряно-кадмиевый аккумулятор
- Серебряно-цинковый аккумулятор
- Цинк-бромный аккумулятор
- Цинк-воздушный аккумулятор
- Цинк-хлорный аккумулятор
Топливные элементы
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
Смотри также Категория: Топливные элементы.
- Прямой метанольный топливный элемент.
- Твердооксидный топливный элемент.
- Щелочной топливный элемент.
АККУМУЛЯТОРЫ
АККУМУЛЯТОРЫ электрические (от лат. accumulator- собиратель, накопитель), хим. источники тока многократного действия. При заряде от внеш. источника электрич. тока в аккумуляторе накапливается энергия, к-рая при разряде вследствие хим. р-ции непосредственно превращ. снова в электрическую и выделяется во внеш. цепь. По принципу работы и осн. элементам конструкции аккумуляторы не отличаются от гальванических элементов, но электродные р-ции, а также суммарная токообразующая р-ция в аккумуляторах обратимы. Поэтому после разряда аккумулятора может быть снова заряжен пропусканием тока в обратном направлении: на положит. электроде при этом образуется окислитель, на отрицательном-восстановитель.
Наиб. распространены свинцовые аккумуляторы, часто наз. также кислотными. Их действие основано на р-ции:
Электролит — р-р H2SO4 с концентрацией 12-24% по массе в разряженном состоянии и 28-40% в заряженном. Напряжение разомкнутой цепи (НРЦ) 1,95-2,15 В. Чаще всего применяют электроды из пасты, содержащей смесь Рb3О4 и РbО с H2SO4 (активная масса); эту пасту намазывают на профилированную сетку-токоотвод из сплава Рb с 2-12% Sb. Электроды формируют, пропуская через р-р электролита зарядный ток в определенном режиме; при этом на одном электроде образуется РbО2, на другом-Рb. Затем электроды отмывают и сушат в условиях, исключающих возможность окисления Рb. Аккумуляторы, собранные из таких электродов, после заливки у потребителя р-ром H2SO4 готовы к эксплуатации без подзаряда (остальные виды аккумуляторов требуют дополнит. заряда). Применяют также панцирные электроды, в к-рых активная масса заключена в перфорированную пластмассовую или тканевую трубку.
Первый свинцовый аккумулятор был создан Г. Планте в 1859. Сейчас более половины мирового произ-ва Рb расходуется на изготовление свинцовых аккумуляторов с единичной емкостью 2-5000 А * ч и уд. энергией 25-40 Вт * ч/кг. Осн. достоинства таких аккумуляторов: относит. дешевизна, пологие разрядная и зарядная кривые, возможность работать в разл. режимах разряда; недостаток — невысокий ресурс работы (число допустимых циклов заряд-разряд для стартерных аккумуляторов 100-300, для тяговых с панцирными электродами 800-1500). В конце заряда на электродах свинцового аккумулятора наблюдается заметное выделение газов, к-рые часто увлекают за собой туман из капель H2SO4. В связи с этим большое внимание уделяется созданию герметизированных свинцовых акуумуляторов.
Щелочные никель-кадмиевые (НКА) и никельжелезные (НЖА) аккумуляторы по распространению занимают второе место после свинцовых. Токообразующая реакция:
где M-Cd или Fe. Электролит-водный р-р КОН, в к-рый иногда вводят LiOH для улучшения работоспособности окисноникелевого электрода. НРЦ составляет 1,30-1,34 В для НКА и 1,37-1,41 В для НЖА (спустя нек-рое время после окончания заряда), уд. энергия 20-35 Вт*ч/кг. Щелочные аккумуляторы имеют, как правило, высокий ресурс — 1-2 тыс. циклов. Электроды м.б. разл. конструкции: ламельные, в к-рых активная масса заключена в плоские коробочки-ламели из перфорированной стальной ленты; спеченные, в к-рых активная масса вводится в поры основы, образуемой при спекании порошкообразного металлич. Ni; прессованные, в к-рых активную массу под давл. 35-60 МПа напрессовывают на стальную основу (толщина пластин 0,8-1,8 мм).
НЖА используют в осн. для изготовления тяговых аккумуляторных батарей большой емкости (до 1200 А * ч). Они дешевле НКА, но характеризуются повыш. саморазрядом из-за коррозии железа в щелочном р-ре; кроме того, у них более низкие значения отдачи по току и по энергии. В НКА не наблюдается коррозии Cd и связанного с ней газовыделения, что обусловливает большую длительность сохранения заряженного состояния и возможность полной герметизации аккумулятора. Герметичные НКА выпускают емкостью от 0,01 до 160 А * ч. Их широко используют как источники электрич. энергии в приборах бытовой техники, ср-вах связи и т.п.
Серебряно-цинковые аккумуляторы со щелочным электролитом имеют высокую уд. энергию (до 130 Вт*ч/кг) и способны разряжаться большими токами, но из-за высокой стоимости серебра нашли применение только в специальных отраслях, напр. в космической технике. Токообразующая р-ция:
При заряде возможно также образование AgO. Поэтому на зарядных и разрядных кривых наблюдаются ступени, соответствующие р-циям с участием Ag2O и AgO. НРЦ 1,60-1,85 В, ресурс не превышает 100-200 циклов.
Попытки замены Ag др. материалами привели к созданию никель-цинковых аккумуляторах, в к-рых используют спеченный или прессованный окисноникелевый электрод от НКА и цинковый электрод от серебряно-цинковых аккумуляторов. Токообразующая р-ция:
НРЦ 1,74-1,78 В, уд. энергия ок. 60 Вт*ч/кг, ресурс ок. 300 циклов. Разрабатываемые варианты этих аккумуляторах предназначены в осн. для электромобилей, но широкому использованию их мешает недостаточный пока ресурс работы.
В никель-водородных аккумуляторах протекает след. токообразующая р-ция:
Выделяющийся при заряде Н2 накапливается под давлением. Поэтому блок с электродами помещают в стальной цилиндр, выдерживающий давления до 10 МПа. НРЦ 1,32-1,36 В, уд. энергия 50-60 Вт*ч/кг, ресурс неск. тысяч циклов. Из-за дороговизны произ-ва такие аккумуляторы применяют пока только в космич. технике.
Среди перспективных конструкций аккумуляторов с неводными электролитами Наиб. интерес представляют серно-натриевые с твердым керамич. электролитом из алюминатов натрия, обладающим проводимостью по ионам Na+ . Рабочая т-ра такого аккумулятора 300-350°С. Токообразующая р-ция:
НРЦ 2,08 В. Осн. трудность при разработке: создание технологии изготовления тонких, но достаточно стойких деталей из твердого электролита. Разрабатывают также высокотемпературные сульфид-железо-литиевые аккумуляторы; в них вместо твердого электролита применяют расплав солей, окислителями служат FeS или FeS2. По своим характеристикам эти аккумуляторы близки к серно-натриевым.
Если требуется более высокое напряжение, чем у отдельного аккумулятора, применяют аккумуляторные батареи, состоящие из последовательно включенных аккумуляторов, имеющих общий корпус, выводы и маркировку. Батареи широко применяют в транспортных ср-вах для запуска двигателей, освещения и др. Тяговые батареи используют для силовых установок электрокаров, стационарные большой емкости-для электропитания телефонных сетей, в кач-ве аварийных источников электроэнергии на случай перебоев в электросети (напр., в операционных). Малогабаритные герметичные батареи применяют для питания переносных радиоприемников и др. устройств. Большое внимание уделяется разработке батарей для электромобилей. Мировое произ-во одних лишь стартерных батарей из свинцовых аккумуляторов превышает 100 млн. штук в год.
В отличие от гальванич. элементов аккумуляторы требуют ухода при эксплуатации: их необходимо заряжать, периодически доливать электролит и поддерживать постоянной его концентрацию, проводить тренировочные и контрольные зарядно-разрядные циклы и т.п. Разрабатывают т. наз. малообслуживаемые и необслуживаемые аккумуляторы, уход за которыми упрощен.
=== Исп. литература для статьи «АККУМУЛЯТОРЫ»: Романов В. В., Хашев Ю. М., Химические источники тока, 2 изд., М., 1978; Багоцкий В.С., Скундин А. М., Химические источники тока, М., 1981. B.C. Багоцкий.
Страница «АККУМУЛЯТОРЫ» подготовлена по материалам химической энциклопедии.
Некоторые виды химических источников тока
Гальванические элементы
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
| Тип | Катод | Электролит | Анод | Напряжение,В |
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
- Свинцово-плавиковый элемент
- Медно-окисный гальванический элемент
- Висмутисто-магниевый элемент
- Ртутно-висмутисто-индиевый элемент
- Литий-хромсеребряный элемент
- Литий-висмутатный элемент
- Литий-окисномедный элемент
- Литий-йодсвинцовый элемент
- Литий-йодный элемент
- Литий-тионилхлоридный элемент
- Литий-оксидванадиевый элемент
- Литий-фторомедный элемент
- Литий-двуокисносерный элемент
- Диоксисульфатно-ртутный элемент
- Серно-магниевый элемент
- Хлористосвинцово-магниевый элемент
- Хлорсеребряно-магниевый элемент
- Хлористомедно-магниевый элемент
- Иодатно-цинковый элемент
- Магний-перхлоратный элемент
- Магний-м-ДНБ элемент
- Цинк-хлоросеребряный элемент
- Хлор-серебряный элемент
- Бром-серебряный элемент
- Йод-серебряный элемент
- Магний-ванадиевый элемент
- Кальций-хроматный элемент
Электрические аккумуляторы
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
Смотри также Категория: Аккумуляторы.
- Железо-воздушный аккумулятор
- Железо-никелевый аккумулятор
- Лантан-фторидный аккумулятор
- Литий-железо-сульфидный аккумулятор
- Литий-ионный аккумулятор
- Литий-полимерный аккумулятор
- Литий-фторный аккумулятор
- Литий-хлорный аккумулятор
- Литий-серный аккумулятор
- Марганцево-оловянный элемент
- Натрий-никель-хлоридный аккумулятор
- Натрий-серный аккумулятор
- Никель-кадмиевый аккумулятор
- Никель-металл-гидридный аккумулятор
- Никель-цинковый аккумулятор
- Свинцово-водородный аккумулятор
- Свинцово-кислотный аккумулятор
- Свинцово-оловянный аккумулятор
- Серебряно-кадмиевый аккумулятор
- Серебряно-цинковый аккумулятор
- Цинк-бромный аккумулятор
- Цинк-воздушный аккумулятор
- Цинк-хлорный аккумулятор
Топливные элементы
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
Смотри также Категория: Топливные элементы.
- Прямой метанольный топливный элемент.
- Твердооксидный топливный элемент.
- Щелочной топливный элемент.
Классификация
Самые распространенные виды — гальванические элементы и аккумуляторы. С ними знаком практически каждый. Но классификация таких приспособлений более широкая и предполагает еще и существование топливных элементов.
Схема классификации источников тока
Гальванические элементы
Гальванический элемент получил свое название в честь ученого Гальвано, который и открыл чудесную возможность получения электрического тока посредством создания простой конструкции из электролита и электродов. Они считаются первыми прототипами современных устройств для получения электроэнергии благодаря химическим реакциям.
Вам это будет интересно Как воздействует электрический ток на организм человека
Химические источники тока — гальванические элементы и аккумуляторы
Обратите внимание! В настоящее время это приспособление имеет более компактный и безопасный для использования вид, это обычная батарейка. Особенность работы такого устройства заключается в том, что использование его одноразовое. После окончательного разложения электролита на вещества, повторно зарядить их для следующих реакций невозможно.
Электрические аккумуляторы
Электрический аккумулятор — это более универсальный вариант устройства, который можно заряжать несколько раз после потери заряда электролита. Такая особенность объясняется регенерацией веществ, которые образуют электролит.
Устройство аккумулятора
В данном случае зарядка производится от постороннего (внешнего) источника тока. Часто с такой потребностью в восстановлении реагента в аккумуляторах сталкиваются автомобилисты, производя зарядку аккумулятора.
Топливные элементы
Электрохимический топливный элемент является перспективным источником, который достаточно важен для создания комфортных и в некоторых ситуациях жизненно необходимых условий существования.
Тепловой химический источник
Особенность работы такого элемента заключается в следующем. К электродам каждый раз поступает определенная порция электролита, которая после разрядки выводится из конструкции. Например, резервный генератор тока благодаря такому принципу работы может производить электроэнергию в течение 10-15 лет.
Обратите внимание! После истечения срока эксплуатацию можно продлить, если восстановить питание.
СвеÑовÑе иÑÑоÑники
СвойÑÑво полÑпÑоводников ÑоздаваÑÑ ÐÐС пÑи попадании на Ð½Ð¸Ñ Ð¿Ð¾Ñока ÑвеÑа иÑполÑзÑеÑÑÑ Ð¿Ñи Ñоздании ÑвеÑовÑÑ Ð¸ÑÑоÑников поÑÑоÑнного Ñока.
ÐбÑединение болÑÑого колиÑеÑÑва кÑемниевÑÑ ÑÑÑÑкÑÑÑ Ð¿Ð¾Ð·Ð²Ð¾Ð»ÑÐµÑ ÑоздаваÑÑ ÑолнеÑнÑе баÑаÑеи. ÐеболÑÑие ÑлекÑÑоÑÑанÑии, ÑозданнÑе на базе ÑÐ°ÐºÐ¸Ñ ÑолнеÑнÑÑ Ð¿Ð°Ð½ÐµÐ»ÐµÐ¹, имеÑÑ Ð½Ð° ÑегоднÑÑний Ð´ÐµÐ½Ñ ÐÐРне более 15%.