Химические источники тока — это устройства и приборы которые в процессе химической окислительно-восстановительной реакции выделяют напряжение. Также они называются электрохимическими, гальваническими элементами. Основной принцип действия их основан на взаимодействии химических реагентов которые вступая, в реакцию друг с другом вырабатывают электроэнергию, в виде постоянного тока. Этот процесс происходит без механического или теплового воздействия, что является основными факторами играющими превосходящую роль среди других генераторов постоянного напряжения. Химические источники тока, сокращённо ХИТ, уже давно нашли применение не только в быту, но и на производстве.
Немного истории создания ХИТ
Ещё в восемнадцатом веке итальянский учёный Луиджи Гальвани придумал простейший элемент который химическим способом выделял электрический ток. Однако он был не только учёным, но и физиком, врачом, физиологом. Он интересовался и проводил опыты которые были направлены на изучение реакции животных на внешние раздражители. Как и всё гениальное первый химический источник энергии был получен Луиджи абсолютно случайно, во время многочисленных экспериментов над лягушками. После присоединения двух пластин из металла к лягушачьей мышце на лапке, было замечено мускульное сокращение. Гальвани посчитал это нервной реакцией на внешний раздражитель и изложил это в результатах своих исследований, попавших в руки другого великого учёного Алессандро Вольта. Он и выложил свою теорию о возникновении напряжения в результате химической реакции, возникшей между двумя металлическими пластинами в среде мускульной ткани лягушки.
Первый химический источник электрического тока представлял собой емкость с соляным составом, в который было погружено две пластины из разных материалов. Одна из меди, другая из цинка. Именно это устройство в будущем, а конкретнее во второй половине девятнадцатого века, было применено при изобретении и создании марганцево-цинкового элемента внутри которого был тот же солевой электролит.
Исследовательская работа на тему: «Химический источник электрического тока» (7-9 класс)
Муниципальное бюджетное учреждение дополнительного образования Первомайского района города Ростова-на-Дону «Дом детского творчества»
Тема: «Химический источник электрического тока»
Бобыльченко Валерий Юрьевич
Педагог дополнительного образования
МБУ ДО ДДТ Первомайского р-на
2019 г.
Введение
Химические источники тока в течение многих лет прочно вошли в нашу жизнь. В быту потребитель редко обращает внимание на отличия используемых химических источниках тока. Для него это батарейки и аккумуляторы. Обычно они используются в устройствах таких, как карманные фонари, игрушки, радиоприемники или автомобили. В том случае, когда потребляемая мощность относительно велика (10Ач), используются аккумуляторы, в основном кислотные, а также никель — железные и никель — кадмиевые. Они применяются в портативных электронных вычислительных машинах, носимых средствах связи, аварийном освещении и пр.
В силу ряда обстоятельств химические генераторы электрической энергии являются наиболее перспективными. Их преимущества проявляются через такие параметры, как высокий коэффициент выхода энергии; бесшумность и безвредность; возможность использования в любых условиях, в том числе в космосе и под водой, в стационарных и переносных устройствах, на транспорте и т.д.
В последние годы такие аккумуляторы широко применяются в резервных источниках питания ЭВМ и электромеханических системах, накапливающих энергию для возможных пиковых нагрузок и аварийного питания электроэнергией жизненно – важных систем.
Актуальность темы
В технике и быту постоянно растет число таких приборов и устройств, для которых требуются автономные, малогабаритные легкие и надежные источники тока. Гальванический элемент или, проще говоря – батарейка, огромную мощность не способна дать, но без неё невозможно обойтись в тех случаях, когда обычная сеть не доступна либо не целесообразно.
Цель
Изготовить простейший гальванический элемент
Задачи
— Ознакомление с историей создания первых гальванических элементов.
— Изучить устройство и принцип действия гальванических элементов.
— Гальванические элементы сегодня.
Химические источники тока: основные характеристики
Уже более двух столетий человечество использует энергию химических реакций между различными веществами для получения постоянного тока.
Принцип работы
Окислительно-восстановительная реакция, протекающая между веществами, обладающими свойствами окислителя и восстановителя, сопровождаются выделением электронов, движение которых образует электрический ток. Однако, чтобы использовать его энергию, необходимо создать условия для прохождения электронов через внешнюю цепь, в противном случае она при простом смешивании окислителя и восстановителя выделяется во внешнюю среду теплом.
Поэтому все химические источники тока имеют два электрода:
- анод, на котором происходит окисление;
- катод, осуществляющий восстановление вещества.
Электроды на расстоянии помещены в сосуд с электролитом — веществом, проводящим электрический ток за счет процессов диссоциации среды на ионы.
Принцип преобразования химической энергии в электрическую
Гальванический элемент — это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Таким образом, в гальванических элементах химическая энергия переходит в электрическую.
Предпосылки к появлению гальванических элементов. В 1786 году итальянский профессор медицины, физиолог Луиджи Алоизио Гальвани обнаружил интересное явление: мышцы задних лапок свежевскрытого трупика лягушки, подвешенного на медных крючках, сокращались, когда ученый прикасался к ним стальным скальпелем. Гальвани тут же сделал вывод, что это — проявление «животного электричества».
После смерти Гальвани, его современник Алессандро Вольта, будучи химиком и физиком, придет к однозначному выводу о том, что ток появляется в цепи из-за наличия в ней двух проводников из разных металлов, помещенных в жидкость, и это вовсе не «животное электричество», как думал Гальвани. Подергивание лапок лягушки было следствием действия тока, возникающего при контакте разных металлов (медные крючки и стальной скальпель).
Вольта покажет те же явления, которые демонстрировал Гальвани на мертвой лягушке, но на совершенно неживом самодельном электрометре, и даст в 1800 году точное объяснение возникновению тока: «проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления».
В одном из первых экспериментов Вольта опустил в банку с кислотой две пластинки — цинковую и медную — и соединил их проволокой. После этого цинковая пластина начала растворяться, а на медной стали выделяться пузырьки газа. Вольта предположил и доказал, что по проволоке протекает электрический ток.
Так был изобретён «элемент Вольта» — первый гальванический элемент. Для удобства Вольта придал ему форму вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой. Вольтов столб высотою в полметра создавал напряжение, чувствительное для человека.
Это изобретение в последствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля». В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах. В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств. В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Опыты В.В. Петрова
Василий Владимирович Петров (1761 — 1834) — русский физик-экспериментатор, электротехник-самоучка, академик Петербургской академии наук Основоположник отечественной электротехники [1].
После открытия Алессандро Вольта прибора, способного создавать непрерывный поток электрических зарядов учёные получили возможность проводить новые опыты с электричеством. В Петербурге опыты с Вольтовым столбом проводил профессор физики Медико-хирургической Академии Василий Владимирович Петров. Он заказал 100 цинковых и 100 медных кружков диаметром по 10 дюймов. Каждый кружок весил более фунта. Из них Петров составил Вольтов столб, применив вместо суконных прокладок бумажные кружки, пропитанные водным раствором нашатыря. Однако мощность прибора не удовлетворила Петрова. Для опытов, которые он задумал, эта батарея была слабовата, и ученый заказал другую — «наипаче огромную батарею, состоявшую иногда из 4200 медных и цинковых кружков».
Батарея В.В. Петрова
В этой батарее Петров не стал располагать кружки столбиком. Столб из 4200 кружков получался, по расчетам Петрова, высотой в 40 футов, то есть более 12 метров. Обращаться с таким столбом было бы затруднительно, пришлось бы ломать потолки в лаборатории, и батарея поднялась бы над крышей здания, как фабричная труба. А главное, ученый опасался, что под тяжестью столба влага из прокладок в нижней части батареи будет выдавлена, и ожидаемого результата не получится.
Петров заказал ящики из красного дерева, разгороженные на восемь отделений. Внутренние стенки ящика и все перегородки он облил расплавленным сургучом. Когда сургуч застыл, получилась твердая, совершенно водонепроницаемая корка, служившая прекрасной изоляцией.
В каждое отделение Петров уложил по 525 медных и цинковых кружков. Все секции своей батареи Петров соединил изолированными проводами, употребляя для изоляции шелк, сургуч, воск, лаки. Это было крупной технической новинкой. Но никто из ученых не понимал тогда, как важно тщательно изолировать проводники. Петров доказал, что только надежно изолированная батарея способна дать наиболее сильный ток.
С помощью своего вольтова столба Петров создал электрическую дугу, — открыл один из видов электрического разряда — дуговой разряд.
Гальванические элементы сегодня
Гальванические элементы сегодня называют батарейками. Широко распространены три типа батареек: солевые (сухие), щелочные (их называют еще алкалиновыми, «alkaline» в переводе с английского — «щелочной») и литиевые. Принцип их работы — все тот же, описанный Вольта в 1800 году: два металла взаимодействуют через электролит, и во внешней замкнутой цепи возникает электрический ток.
Напряжение батарейки зависит как от используемых металлов, так и от количества элементов в «батарейке». Батарейки, в отличие от аккумуляторов, не способны к восстановлению своих свойств, поскольку в них происходит прямое преобразование энергии химической, то есть энергии составляющих батарейку реагентов (восстановителя и окислителя), в энергию электрическую.
Входящие в батарейку реагенты, в процессе ее работы расходуются, ток при этом постепенно уменьшается, поэтому действие источника заканчивается после того как реагенты прореагируют полностью.
Солевые батарейки
Марганцево-цинковые элементы, которые называют солевыми батарейками — это «сухие» гальванические элементы, внутри которых нет жидкого раствора электролита.
Цинковый электрод (+) — это катод в форме стакана, а анодом служит порошкообразная смесь из диоксида марганца с графитом. Ток течет через графитовый стержень. В качестве электролита используется паста из раствора хлорида аммония с добавлением крахмала или муки для загущения, чтобы ничего не текло.
Обычно производители батареек не указывают точный состав солевых элементов, тем не менее, солевые батарейки являются самыми дешевыми, их обычно используют в тех устройствах, где энергопотребление крайне низко: в часах, в пультах дистанционного управления, в электронных термометрах и т. п.
Щелочные (алкалиновые) батарейки
Щелочной элемент питания — марганцево-цинковый гальванический элемент питания, в котором в качестве катода используется диоксид марганца, в качестве анода — порошкообразный цинк, а в качестве электролита — раствор щёлочи, обычно в виде пасты гидроксида калия.
Эти батарейки обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).
Щелочные батарейки, в сравнении с солевыми, могут обеспечивать больший ток в течение длительного времени. Больший ток становится возможным, поскольку цинк здесь используется не в виде стакана, а в виде порошка, обладающего большей площадью соприкосновения с электролитом. В качестве электролита применяется гидрооксид калия в виде пасты.
Именно благодаря способности данного вида гальванических элементов в течение длительного времени отдавать значительный ток (до 1 A), щелочные батарейки наиболее распространены в настоящее время. Они служат в 1,5 раза дольше солевых, если разряд идет малым током.
Литиевые батарейки
Еще одним достаточно распространенным видом гальванических элементов являются литиевые батарейки — одиночные неперезаряжаемые гальванические элементы, в которых в качестве анода используется литий или его соединения. Благодаря использованию щелочного металла они обладают высокой разностью потенциалов.
Катод и электролит литиевого элемента могут быть очень разными, поэтому термин «литиевый элемент» объединяет группу элементов с одинаковым материалом анода. В качестве катода могут использоваться например: диоксид марганца, монофторид углерода, пирит, тионилхлорид и др.
Литиевые батарейки отличается от других элементов питания высокой продолжительностью работы и высокой стоимостью. Литиевые элементы широко применяются в современной портативной электронной технике: для питания часов на материнских платах компьютеров, для питания портативных медицинских приборов, наручных часов, калькуляторов, в фототехнике и т. д.
Практическая часть
Ряд напряжений металлов – необходим в нашем случае. Мы, как и Алессандро Вольта, будем знать – чем дальше металлы отстоят друг от друга, тем большее напряжение удастся получить.
В своих опытах, как и классики, мы использовали медь и цинк. При погружении пластинок в электролит, между ним и цинковой пластинкой, происходит химическая реакция, в результате которой на пластинке скапливаются отрицательные заряды и она заряжается отрицательно. В результате реакции происходящей в гальваническом элементе, цинковый электрод постепенно растворяется.
На медном электроде, при работе гальванического элемента, образуются мельчайшие пузырьки водорода, изолирующие поверхность меди от электролита. Явление называется газовой поляризацией, в гальваническом элементе оно вредно, с ним борются. Для удаления выделяющегося водорода, в электролит вводятся вещества связывающие водород, называемые деполяризаторами. В их роли часто выступают соединения марганца, медный купорос. В простых опытах, можно применить аптечный перманганат калия.
Приборы и материалы.
Для сборки гальванических элементов, в качестве медных электродов, можно использовать проволоку, провод, фольгу. Цинк можно извлечь из сухих элементов, применить оцинкованные изделия. Вместо цинкового, можно попробовать применить электрод из алюминия или железа. Поваренная соль для электролита, немного мягкого монтажного провода. Непременно нужен вольтметр или мультиметр, кусачки, ножницы. В качестве сосудов, можно применять неметаллические емкости подходящего размера. Стеклянные, удобнее легких пластиковых стаканчиков – они тяжелее, устойчивее, опрокинуть их труднее. Очень хорошо, если найдется слаботочная низковольтная нагрузка – кварцевые часы. «Высоковольтная» батарея из проволоки и саморезов.
Первоначально мы собрали такую батарею (см. рисунок). Здесь применяется «классическая» пара металлов – медь-цинк. Идея состоит в применении в качестве цинкового электрода, оцинкованного болта. Понятно, что на длительную работу, такой элемент не рассчитан – тонкий слой цинка быстро растворится, однако, для кратковременного эксперимента это и не важно. В качестве медного электрода применена проволока – также, широко доступный материал, кроме того – удобнейший монтаж элементов в батарею – все элементы соединены последовательно – плюс одного к минусу следующего. При этом напряжение суммируется, ток остается прежним.
Опыт 1.
Сборка батареи – в качестве емкости использовано ячейки от коробочных конфет. После установки электродов на стенках между ячейками, заполняем емкости электролитом. Мы использовали раствор поваренной соли – столовую ложку с горкой на 0,5 л теплой воды.
Опыт 2.
Вместо цинка использовали свинец в качестве электрода. Электролит поместили в стеклянный стакан. Напряжение получили низкое – 0, 02 В.
Опыт 3.
Вместо свинца использовали графит. Напряжение – больше 1В. На графите выделился водород в виде пузырьков.
Опыт 4.
Оцинкованный болт и медь. Напряжение меньше 1 В.
Опыт 5.
Последовательно увеличиваем количество стаканов. В качестве нагрузки поочередно подключаем кварцевые часы и светодиод, соблюдая полярность.
Вывод
Практика предъявляет к современным гальваническим элементам весьма разнообразные требования. В следствие все возрастающего и весьма разнообразного спроса на гальванические элементы в последнее время вновь расширяются научные исследования, направленные на разработку новых и усовершенствование старых типов элементов.
Гальванические элементы как источники электрической энергии обладают существенными преимуществами: они могут быть различных размеров и форм, не имеют макроскопически подвижных, подверженных износу частей, относительно легки и автономны, мало чувствительны к вибрации и колебаниям температуры, работают бесшумно, хорошо регулируются. Их КПД довольно высок (до 90%), так как превращение химической энергии в электрическую совершается в них без промежуточной тепловой стадии, а электродные процессы в некоторых случаях близки к обратимым.
Список литературы
1. Электротехнический справочник. В 3-х т. Т.2. Электротехнические изделия и устройства/под общ. ред. профессоров МЭИ (гл. ред. И. Н. Орлов) и др. 7 изд. 6 испр. и доп. М.: Энергоатомиздат, 1986. 712 с.
2. Багоцкий В.С., Скундин А.М. Химические источники тока. М.: Энергоиздат, 1981. 360 с.
3. Кромптон. Т. Первичные источники тока. Москва. «Мир». 1986.г.
Электронные ресурсы:
1. Андрей Повный https://electrik.info/main/school/1267-galvanicheskie-elementy-ustroystvo.html
2. https://vashtehnik.ru/enciklopediya/galvanicheskij-element.html
3. https://school-science.ru/5/11/34665
4. https://mirznanii.com/a/321369/galvanicheskie-elementy
Принцип действия
Источники питания 24 и 12 Вольт
Устройства вырабатывающее электрический ток содержит два электрода, которые помещаются между электролитом. Именно на их границе соприкосновения и появляется небольшой потенциал. Один из них называют катодом, а другой анодом. Все эти элементы вместе образуют электрохимическую систему. Во время возникновения окислительно-восстановительной реакции между электродами один элемент отдаёт мельчайшие частицы электроны другому. Поэтому она и не может происходить вечно, а со временем просто теряются свойства каждого элемента этой цепи. Электроды могут быть представлены в виде пластин или решёток из металла. После погружения их в среду с электролитом меду их выводами возникает разность потенциалов, которая именуется напряжением разомкнутой цепи. Даже при удалении хотя бы одного из электродов с электролита процесс генерации напряжения прекращается.
Состав электрохимических систем
В качестве электролита используются следующие химические вещества:
- Водные растворы на основе щелочей, кислот, солей и т. д.;
- Растворы с ионной проводимостью на неводной основе, которые получены при растворении солей в неорганических или органических растворителях;
- Твердые соединения, содержащие ионную решетку, где один из ионов является подвижным;
- Матричные электролиты. Это особый вид жидких растворов и расплавов, которые находятся в порах твёрдого непроводящего элемента — электроносителя;
- Расплавы солей;
- Ионообменные электролиты с униполярной системой проводимости. Твёрдые тела с фиксированной ионогенной группой одного знака.
Принцип работы
Химический источник, который вырабатывает постоянный ток, имеет определенный принцип работы. Алгоритм выработки электроэнергии посредством протекания химических реакций между некоторыми веществами достаточно прост для понимания, разобраться с этим сможет человек, далекий от химии или физики.
Важно! Из-за использования достаточно агрессивных типов веществ, которые входят в состав таких источников, самостоятельно вскрывать конструкции запрещено. Это может нанести вред здоровью и жизни. Дополнительно требуется определенная утилизация.
Между окислителем и восстановителем (электролитом) протекает окислительно-восстановительная реакция. В результате выделяются электроны, которые начинают последовательно двигаться в определенном направлении. Именно благодаря выделенной в результате химреакции энергии и происходит движение элементарных заряженных частиц.
Так и получается электрический ток, который нужно уметь еще и добыть. Если не создать нужные условия для выхода электронов на внешнюю цепь, то вещество будет выделять только тепло. Чтобы это сделать, нужно подготовить два электрода: анод (где происходит окисление) и катод (восстанавливает вещество).
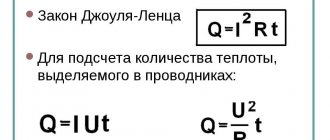
Вам это будет интересно Формулы электрического тока
Принцип устройства химического источника тока
Величина электроэнергии, которая получается в результате протекания окислительно-восстановительной реакции, зависит от таких факторов:
- объем и концентрация электролита;
- материал, из которого изготовлены электроды;
- конструкция внешней электрической цепи.
Есть несколько вариантов наиболее эффективных и применяемых электролитов с определенной концентрацией и массой.
Классификация гальванических элементов и их подбор
Основные понятия о релейной защите
Генераторы электрического тока получающегося во время химической реакции разделяются по:
- Размерам;
- Конструктивным особенностям;
- Способу и реагенту, за счёт которого, и получается электроэнергия.
Все элементы вырабатывающее ток во время химической реакции делятся на:
- Заряжаемые, которые в процессе эксплуатации могут неоднократно заряжаться от источника постоянного тока, они называются аккумуляторами;
- Не заряжаемые, то есть источники одноразового использования которые после завершения химической реакции просто приходят в негодность и должны быть утилизированы. Попросту это гальванический элемент или батарейка.
Для того чтобы подобрать источник электроэнергии, основанный на химической реакции, нужно понимать его характеристики, к которым относятся:
- Напряжение между анодом и катодом при разомкнутой цепи. Этот показатель чаще всего зависит от выбранной электрохимической системы, а также концентрации и вылечены всех составляющих;
- Мощность источника;
- Показатель силы тока;
- Емкость;
- Электротехнические показатели, то есть количество циклов заряда и разряда;
- Диапазон рабочих температур;
- Срок хранения между тем временем как элемент был создан и до начала его эксплуатации;
- Полный срок службы;
- Прочность, то есть защита корпуса от различных механических повреждений и влияний, а также вибраций;
- Положение работы, некоторые из них работают только в горизонтальных положениях;
- Надёжность;
- Простота в эксплуатации и обслуживании. В идеале отсутствие необходимости малейшего вмешательства в работу в течение всего срока эксплуатации.
При выборе нужной батареи или аккумулятора обязательно нужно учесть его электрические номиналы такие как напряжение и ток, а также ёмкость. Именно она является ключевой для сохранения работоспособности, подключаемого к источнику прибора.
Современные химические источники тока и их применение
Знакомство с пиковыми и другими зонами тарификации электроэнергии
Современный быт человека тяжело приставить без этих мобильных генераторов энергии, с которыми он сталкивается в течение всей жизни, начиная с детских игрушек и заканчивая, допустим, автомобилем.
Сферы применения различных батареек и аккумуляторов настолько разнообразны что перечислить их очень сложно. Работа любого мобильного телефона, компьютера, ноутбука, часов, пульта дистанционного управления была бы невозможна без этого переносного и очень компактного устройства для создания стабильного электрического заряда. В медицине широко используются источники химической энергии при создании любого аппарата, помогающего человеку полноценно жить. Например, для слуховых аппаратов и электрокардиостимуляторов которые могут работать только от переносных источников напряжения, чтобы не сковывать человека проводами. В производстве применяются целые системы аккумуляторных батарей для обеспечения напряжением цепей отключения и защит в случае пропадания входящего высокого напряжения на подстанциях. И также широко применяется это питание во всех транспортных средствах, военной и космической технике. Одним из видов распространённых батарей являются литиевые источники электрического тока, так как именно этот элемент обладает высоким показателем удельной энергии. Дело в том что только этот химический элемент, оказывается, обладает сильным отрицательным потенциалом среди всех известных и изученных человеком веществ. Литий-ионные батареи выделяются среди всех остальных элементов питания по величине вырабатываемой энергии и низким габаритам, что позволяет применять их в самых компактных и мелких электронных устройствах.
Классификация
Самые распространенные виды — гальванические элементы и аккумуляторы. С ними знаком практически каждый. Но классификация таких приспособлений более широкая и предполагает еще и существование топливных элементов.
Схема классификации источников тока
Гальванические элементы
Гальванический элемент получил свое название в честь ученого Гальвано, который и открыл чудесную возможность получения электрического тока посредством создания простой конструкции из электролита и электродов. Они считаются первыми прототипами современных устройств для получения электроэнергии благодаря химическим реакциям.
Вам это будет интересно Обозначение электрической цепи
Химические источники тока — гальванические элементы и аккумуляторы
Обратите внимание! В настоящее время это приспособление имеет более компактный и безопасный для использования вид, это обычная батарейка. Особенность работы такого устройства заключается в том, что использование его одноразовое. После окончательного разложения электролита на вещества, повторно зарядить их для следующих реакций невозможно.
Электрические аккумуляторы
Электрический аккумулятор — это более универсальный вариант устройства, который можно заряжать несколько раз после потери заряда электролита. Такая особенность объясняется регенерацией веществ, которые образуют электролит.
Устройство аккумулятора
В данном случае зарядка производится от постороннего (внешнего) источника тока. Часто с такой потребностью в восстановлении реагента в аккумуляторах сталкиваются автомобилисты, производя зарядку аккумулятора.
Топливные элементы
Электрохимический топливный элемент является перспективным источником, который достаточно важен для создания комфортных и в некоторых ситуациях жизненно необходимых условий существования.
Тепловой химический источник
Особенность работы такого элемента заключается в следующем. К электродам каждый раз поступает определенная порция электролита, которая после разрядки выводится из конструкции. Например, резервный генератор тока благодаря такому принципу работы может производить электроэнергию в течение 10-15 лет.
Обратите внимание! После истечения срока эксплуатацию можно продлить, если восстановить питание.
Способы утилизации химических источников энергии
Проблема утилизации разных по габаритах химических источников напряжения является экологической проблемой всей планеты. Современные источники содержат в себе до тридцати химических элементов которые могут нанесите ощутимый вред природным ресурсам, поэтому для их утилизации разработаны целые программы и построены специализированные цеха по переработке. Некоторые методы позволяют не только качественно перерабатывать эти вредные вещества, но и возвращать в производство, тем самым защитив окружающую среду. В целях извлечения цветных металлов из батарей и аккумуляторов в настоящий момент разработаны и применены в цивилизованных странах, следящих и заботящихся об окружающей среде, целые пирометаллургические и гидрометаллургические комплексы. Самый же распространённый способ утилизации отработанных химических источников тока является метод, работающий на соединении этих процессов. Главным его достоинством считается высокая степень извлечения с минимальным количеством отходов. Этот метод пирометаллургической, гидрометаллургической и механической переработки включает в себя восемь основных стадий:
- Измельчение;
- Магнитная сепарация;
- Обжиг;
- Дополнительное измельчение;
- Выделение крупных и мелких элементов с помощью грохочения;
- Водное очищение и выщелачивание;
- Сернокислотное выщелачивание;
- Электролиз.
Организация правильного сбора и утилизации ХИТ позволяет максимально уменьшить негативное влияние как на окружающую природу, так и на здоровье самого человека.