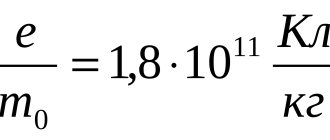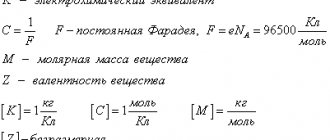4.7
Средняя оценка: 4.7
Всего получено оценок: 61.
4.7
Средняя оценка: 4.7
Всего получено оценок: 61.
Электролиты – вещества, растворы или расплавы которых способны проводить электричество. Движение электрического тока в электролитах называется электролизом.
Передача электричества
Электрический ток – это упорядоченное движение заряженных частиц. Носителями заряда электрического тока в электролитах являются ионы. Они образуются в результате распада (электролитической диссоциации) молекул вещества под действием молекул воды в растворе или при нагревании и образовании расплава.
Расщепление молекул происходит за счёт разрыва полярных ковалентных или ионных связей. Интенсивность диссоциации зависит от температуры и концентрации раствора. Также на степень диссоциации влияет природа электролита. В связи с этим выделяют:
- слабые электролиты, распадающиеся частично или не распадающиеся вообще;
- сильные электролиты, быстро распадающиеся на ионы.
К слабым электролитам относится большинство органических веществ, слабые кислоты, плохо растворимые соли и нерастворимые основания. Сильные кислоты, щёлочи, соли относятся к сильным электролитам.
Рис. 1. Процесс электролитической диссоциации.
Образованные в результате диссоциации ионы делятся на два типа:
- катионы – положительно заряженные частицы;
- анионы – отрицательно заряженные частицы.
Проводником электрического тока в электролитах является электрод. Он может быть анодом или катодом. Анод присоединён к положительному полюсу источника тока, катод – к отрицательному. Анод окисляет вещества, находящиеся в электролите, катод – восстанавливает.
Рис. 2. Электроды.
Если в раствор электролита поместить два электрода – катод и анод – и включить электрический ток, то ионы начнут двигаться под действием электрического поля. Катионы устремятся к катоду, анионы – к аноду. Достигнув электродов, ионы нейтрализуются, превращаются в нейтральные атомы и оседают.
Процесс разложения вещества на составные части, которые оседают на электродах, называется электролизом.
Передача электротока
Электроток представляет собой упорядоченное движение свободных зарядов. Чтобы выяснить, как электрический ток проводится в растворах, следует понять, какие частицы являются его носителями. В твердых телах ток создается электронами. Носителями электрического тока в электролитах являются ионы. Эти частицы образуются в результате процесса распада (электрической диссоциации) молекул вещества под воздействием воды в растворах либо при нагревании и последующем появлении расплава.
Молекулы веществ распадаются благодаря разрыву ионных либо полярных ковалентных связей. Количество носителей заряда в электролите определяют концентрация и температура. Кроме того, степень распада молекул зависит от природы электролита. В результате они делятся на две группы:
- слабые — не подвержены распаду либо этот процесс протекает крайне медленно;
- сильные — в таких электролитах наблюдается быстрое расщепление молекул на ионы.
К первой группе принадлежит большая часть органических веществ — нерастворимые основания, слабые кислоты и плохо растворимые соли. Сильными электролитами являются щелочи, сильные кислоты и хорошо растворимые соли.
Закон Фарадея
Процесс электролиза экспериментально изучил английский физик и химик Майкл Фарадей в 1833 году. Он сформулировал закон, согласно которому масса выделившегося на электроде вещества прямо пропорциональна прошедшему через электролит заряду. Этот закон закрепился в науке как первый закон Фарадея.
Рис. 3. Майкл Фарадей.
m = kQ = kIt,
где:
- m – масса вещества;
- Q – заряд;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время действия тока.
Согласно второму закону Фарадея масса выделившегося на электроды вещества прямо пропорциональна отношению молярной массы к валентности и равна электрохимическому эквиваленту.
m = k = M/z,
где:
- m – масса выделившегося вещества;
- k – электрохимический эквивалент;
- M – молярная масса;
- z – валентность вещества.
Электролиз используется в щелочных и кислотных аккумуляторах. С помощью электролиза можно защитить изделие металлическим покрытием.
Ионная проводимость
В металлах, как вы помните, имеется лишь один тип свободных зарядов — это свободные электроны. В электролитах ситуация иная: здесь возникают свободные заряды двух типов.
1. Положительные ионы, образовавшиеся из атомов металлов или водорода.
2. Отрицательные ионы — атомные или молекулярные кислотные остатки (например, или ), а также гидроксильная группа .
Второе отличие от металлов заключается в том, что носители свободных зарядов в электролите могут иметь заряд, равный по модулю как элементарному заряду , так и целому числу элементарных зарядов . Здесь — валентность атома или группы атомов; например, при растворении медного купороса имеем .
Если внешнего электрического поля нет, то свободные заряды электролита совершают лишь хаотическое тепловое движение наряду с окружающими молекулами. Но при наложении внешнего поля положительные и отрицательные ионы начинают упорядоченное движение.
Поместим в сосуд с электролитом два электрода; один из электродов присоединим к положительной клемме источника тока, а другой — к отрицательной (рис. 5). Когда речь идёт о прохождении тока через электролиты, положительный электрод называют анодом
, а отрицательный —
катодом
(Имеется народная мудрость для запоминания знаков анода и катода:
Андрей — парень положительный, Катька — девка отрицательная
;-)).
Рис. 5. Ионная проводимость электролита
В электрическом поле, возникшем между электродами, положительные ионы электролита устремляются к «минусу» катода, а отрицательные ионы — к «плюсу» анода. Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду
. Поэтому проводимость электролитов называется
ионной
(в отличие от электронной проводимости металллов).
На положительном аноде имеется недостаток электронов. Отрицательные ионы, достигнув анода, отдают ему свои лишние электроны; эти электроны отправляются по цепи к «плюсу» источника.
Наоборот, на отрицательном катоде — избыток электронов. Положительные ионы, придя на катод, забирают у него электроны, и это количество ушедших электронов немедленно восполняется их доставкой на катод с «минуса» источника.
Таким образом, в той части цепи, которая состоит из источника тока и металлических проводников, возникает циркуляция электронов по маршруту «анод источник катод».
Цепь замыкается электролитом, где электрический ток обеспечивается двусторонним движением ионов.
Электрический ток в электролитах
В жидких проводниках (электролитах) происходит непрерывный самопроизвольный распад молекул на составные части . Иногда этот процесс называется процессом диссоциации молекул. Например, молекула медного купороса CuS04 распадается на положительный ион меди Cu и отрицательный ион S04 (так называемый кислотный остаток). В электролите происходит беспорядочное тепловое движение ионов и молекул. Ионы соединяются, образуют молекулы, вновь распадаются и т. д. В целом раствор электрически нейтрален, так как количество положительных и отрицательных ионов в нем одинаковое.
Проделаем следующий опыт. В стеклянный сосуд с раствором медного купороса (CuS04) опустим две медные пластины (электроды) и подключим их к источнику электрической энергии (рис. 1). Пластина, соединенная с положительным полюсом источника, называется анодом (эта пластина имеет положительный потенциал), а другая, соединенная с отрицательным- полюсом,— катодом (эта пластина имеет отрицательный потенциал).
Рисунок 1. Прохождение электрического тока через раствор медного купороса.
Как только мы подключим пластины к источнику электрической энергии, между ними образуется электрическое поле. На положительные и отрицательные ионы, находящиеся в растворе, начнут действовать электрические силы.
Очевидно, что отрицательные ионы (SO4) пойдут к аноду, а положительные (Сu)—к катоду, т. е. в электролите начнется упорядоченное движение ионов. Это упорядоченное движение ионов в электролите под воздействием сил электрического поля и называется ионным электрическим током. Ионный электрический ток существует до тех пор, пока между электродами имеется разность потенциалов.
Мы видим существенное отличие электрического тока в электролите от электрического тока в металлическом проводнике: первый создается движением ионов, а второй — свободных электронов.
Что же будет происходить в электролите после того, как положительные ионы подошли к катоду, а отрицательные — к аноду?
Положительные ионы (Сu) присоединяют недостающие электроны и превращаются в молекулы чистой меди. Молекулы меди в виде тончайшего слоя отлагаются на катоде. Отрицательные ионы отдают излишние электроны аноду и вступают в химическую реакцию с материалом анода, т. е. с медью, образуя молекулы медного купороса (CuSO4). Эти молекулы вступают в электролит.
Таким образом, в электролите при прохождении электрического тока происходит следующий процесс: катод покрывается слоем меди, выделяющейся из электролита, а анод растворяется и пополняет убыль меди в электролите.
Определение: Процесс прохождения ионного электрического тока в электролите, сопровождающийся химическими превращениями вещества и выделением его, получил название электролиза
Честь открытия явления электролиза принадлежит русскому академику Б. С. Якоби. В настоящее время явление электролиза широко применяется в промышленности (очистка металлов, снятие копий с различных предметов, никелирование, золочение, серебрение и т. д.).
ПОНРАВИЛАСЬ СТАТЬЯ? ПОДЕЛИСЬ С ДРУЗЬЯМИ В СОЦИАЛЬНЫХ СЕТЯХ!
Похожие материалы:
- Протекание тока
- Электрический ток в металлических проводниках
- Электродвижущая сила (ЭДС) источника энергии
- Направление и величина электрического тока. Количество электричества
- Электрическое сопротивление проводника. Электрическая проводимость
- Ток смещения в диэлектрике
- Электрический ток в полупроводниках
- Электрический ток в газах
Добавить комментарий
Электрическая диссоциация
Это основополагающий процесс для появления электротока в растворах, поэтому его необходимо рассмотреть более подробно. Все ионы, образующиеся при распаде молекул, можно разделить на 2 типа:
- Анионы. Имеют отрицательный заряд.
- Катионы. Обладают положительным зарядом.
- угол между центральными линиями атомов равен примерно 104,5 градуса;
- электронны смещены в направлении кислорода.
Большинство свойств воды обусловлено полярностью молекул вещества. Говоря иначе, с точки зрения электротехники они являются диполями. Здесь следует вспомнить определение диполи — это система двух частиц, расположенных близко друг к другу. При этом их заряды противоположны по знаку, но одинаковы по модулю. Свойство полярности H2O объясняется геометрическим строением молекул вещества:
Являясь диполями, молекулы воды способны создавать вокруг себя электрополе, которое воздействует не только на них, но и на частицы растворенного вещества.
Чтобы установить, какова природа процесса распада молекул на ионы, следует рассмотреть раствор поваренной соли. На внешней орбите атома натрия расположен лишь 1 электрон. Его связь с атомом слаба, поэтому он способен быстро уйти со своего места. У атома хлора на внешней орбите находится уже 7 электронов и до комплекта не хватает одной частицы. Благодаря этому при образовании кристалла NaCl внешний электрон натрия присоединяется к атому хлора. В итоге образуется диполь.
Взаимодействие двух видов диполей и способствуют активизации процесса растворения. Если в раствор электролита поместить 2 электрода — катод (отрицательный) и анод (положительный), то свободные ионы устремятся к ним. При этом направление их движения протекает по конкретным правилам:
- катионы направятся к катоду;
- анионы начинают двигаться в направлении анода.
Как только переносчики электротока достигают электродов, они теряют свой заряд, превращаясь в нейтральные, и оседают на поверхности электродов.